题目内容
【题目】硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性氧化铁为主。经磁选获得精矿,可直接用于高炉炼铁。已知某精矿的主要成分是磁性氧化铁( Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧)。请回答下列问题:
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是________(答案用小数表示,保留3位小数)。
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁____吨(答案保留3位小数)。
(3)煅烧硫铁矿常用富氧空气。从沸腾炉排出的气体成分如下表。如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为_________。
气体 | SO2 | N2 | O2 |
物质的量 | 10 | 58 | 6 |
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为________(最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | I | II | III |
加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为________________。
③若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数)_______________。
【答案】0.315 0.560 39:116 50:1 1.25 mol/L 设恰好溶解时钢样的质量为x,对于实验I和III,![]() x=7.030g
x=7.030g
此时加入的钢样的质量为m=7.030-5.624=1.406g
a.当钢样粉末中的铁未全部溶解时,即m>1.406g
反应结束后剩余固体的质量为m+5.624-0.125×56=(m-1.376)g
b.当钢样粉末中的铁全部溶解时,即m≤1.406g
反应结束后剩余固体的质量为 (m+5.624)×![]() g 或 (m+5.624)×
g 或 (m+5.624)×![]() g
g
【解析】
(1)依据硫铁矿石(主要成分FeS2)中铁元素和硫元素质量之比计算;
(2)依据硫元素守恒得到矿石中铁元素的质量,结合生铁中铁元素含量为1-4%计算得到;
(3)依据反应和图表数据计算消耗氧气的量,依据气体体积之比等于物质的量之比计算得到;
(4)A根据n=![]() 计算二氧化碳的物质的量,利用碳元素守恒计算n(C),再根据m=nM计算碳的质量,进而计算Fe的质量,再根据n=
计算二氧化碳的物质的量,利用碳元素守恒计算n(C),再根据m=nM计算碳的质量,进而计算Fe的质量,再根据n=![]() 计算Fe的物质的量,据此解答;
计算Fe的物质的量,据此解答;
②硫酸的体积一定,由表中数据可知,样品质量增大,生成气体的体积都增大,故第Ⅰ、Ⅱ组样品完全反应,酸有剩余,8.436g样品完全反应可以生成气体![]() ×1.12L=3.36L>2.8L,故第Ⅲ组硫酸不足,样品完全反应.根据第Ⅲ组氢气的体积计算硫酸的物质的量,再根据c=
×1.12L=3.36L>2.8L,故第Ⅲ组硫酸不足,样品完全反应.根据第Ⅲ组氢气的体积计算硫酸的物质的量,再根据c=![]() 计算硫酸的浓度;
计算硫酸的浓度;
③根据铁是否完全溶解推论计算,剩余固体为碳与剩余铁的质量。
(1)硫铁矿石(主要成分FeS2)中铁元素和硫元素质量之比=56:64,质量之比等于质量分数之比得到,铁元素的质量分数=![]() =0.315;
=0.315;
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),依据工业生产流程和元素守恒得到:设铁元素质量为X,

![]() =
=![]() ,X=0.5376t,生产含碳4.00%的生铁中铁元素含量为96.00%,生铁的质量=
,X=0.5376t,生产含碳4.00%的生铁中铁元素含量为96.00%,生铁的质量=![]() =0.560t;
=0.560t;
(3)假设生成5molFe的氧化物,同时生成10molSO2,消耗O2的物质的量为![]() +10=
+10=![]() mol 于是原有O2:
mol 于是原有O2:![]() mol+6=
mol+6=![]() mol,原有N2:58mol,则所求富氧空气中O2和N2的体积比=
mol,原有N2:58mol,则所求富氧空气中O2和N2的体积比=![]() mol:58=39:116;
mol:58=39:116;
(4)①二氧化碳的物质的量为![]() =0.01mol,根据碳元素守恒n(C)=0.01mol,故m(C)=0.01mol×12g/mol=0.12g,故Fe的质量为28.12g-0.12g=28g,Fe的物质的量为
=0.01mol,根据碳元素守恒n(C)=0.01mol,故m(C)=0.01mol×12g/mol=0.12g,故Fe的质量为28.12g-0.12g=28g,Fe的物质的量为![]() =0.5mol,故此钢样粉末中铁和碳的物质的量之比为0.5mol:0.01mol=50:1;
=0.5mol,故此钢样粉末中铁和碳的物质的量之比为0.5mol:0.01mol=50:1;
②硫酸的体积一定,由表中数据可知,样品质量增大,生成气体的体积都增大,故第Ⅰ、Ⅱ组样品完全反应,酸有剩余,8.436g样品完全反应可以生成气体![]() ×1.12L=3.36L>2.8Lg,故第Ⅲ组硫酸不足,样品完全反应.氢气的物质的量为
×1.12L=3.36L>2.8Lg,故第Ⅲ组硫酸不足,样品完全反应.氢气的物质的量为![]() =0.125mol,由氢原子守恒可知硫酸的物质的量为0.125mol,故硫酸的浓度为
=0.125mol,由氢原子守恒可知硫酸的物质的量为0.125mol,故硫酸的浓度为![]() =1.25mol/L,
=1.25mol/L,
③令Ⅱ组中生成氢气为![]() =0.1mol,根据电子注意守恒可知n(Fe)=0.1mol,则n(C)=
=0.1mol,根据电子注意守恒可知n(Fe)=0.1mol,则n(C)=![]() =0.002mol,
=0.002mol,
a.当钢样粉末中的铁未全部溶解时,即m>1.406g,反应结束后剩余固体的质量为m+5.624-0.125×56=(m-1.376)g;
b.当钢样粉末中的铁全部溶解时,样品中Fe的总物质的量小于或等于0.125mol,故加入的Fe的物质的量小于或等于0.125mol-0.1mol=0.025mol,则m≤![]() ×5.624=1.406g,此时属于固体碳的质量为(m+5.624)×
×5.624=1.406g,此时属于固体碳的质量为(m+5.624)×![]() g。
g。

 口算题天天练系列答案
口算题天天练系列答案【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
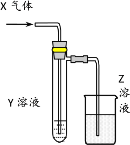
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D