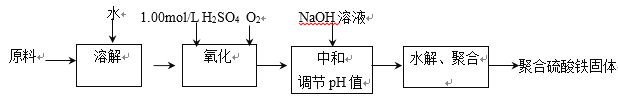
题目内容
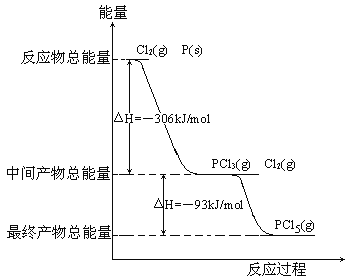
【题目】氯化汞(HgCl2)可用于木材和解剖标本的保存、皮革鞣制和钢铁镂蚀,是分析化学的重要试剂,还可做消毒剂和防腐剂。HgCl2在水中稍有水解:HgCl2+H2O![]() Hg(OH)Cl+HCl
Hg(OH)Cl+HCl
(1)为了抑制上述反应中HgCl2的水解,可以采取的措施是_________。(选填编号)
a.加水稀释 b. 增加HCl的浓度 c.及时移走产物 d.降温
(2)HgCl2与稀氨水反应则生成难溶解的氨基氯化汞,化学方程式为HgCl2+2NH3→Hg(NH2)Cl↓+NH4Cl,上述反应的短周期元素中,非金属性最强元素原子的最外层轨道排布式为__________,该原子核外电子云有_________种不同的伸展方向。
(3)已知PCl3与NH3分子结构相似,PCl3的电子式是_______________;PCl3与NH3的沸点比较,______高,其原因是_______________________。
(4)氮的一种氢化物HN3可用于有机合成,其酸性与醋酸相似,若HN3与氨水混合,此反应的化学方程式是_______________________。
(5)若将0.4mol/LNH4Cl与0.2mol/LNaOH溶液等体积混合后,PH=10,下列关系正确的是(______)
A.c(NH4+)>c(OH-)>c(Na+)>c(NH3H2O) >c(H+)
B.c(NH4+)>c(Na+)>c(OH-)>c(NH3H2O) >c(H+)
C.c(NH4+)>c(Na+)>c(OH-)>c(H+)>c(NH3H2O)
D.c(NH4+)>c(Na+)>c(NH3H2O) >c(OH-)>c(H+)
【答案】b、d ![]() 4
4 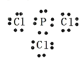 PCl3 两者都是分子晶体,相对分子质量越大,分子间作用力越大,沸点越高 HN3+NH3.H2O=NH4N3+H2O D
PCl3 两者都是分子晶体,相对分子质量越大,分子间作用力越大,沸点越高 HN3+NH3.H2O=NH4N3+H2O D
【解析】
(1)从化学平衡的角度分析,使平衡逆向移动所采取的措施;
(2)所涉及的元素中非金属性最强元素是氯,根据核外电子排布规律写出氯原子最外层电子排布式,确定电子云的空间伸展方向;
(3)仿照氨气的电子式,写出PCl3的电子式 ,从分子 晶体的角度考虑沸点的高低;
(4)仿照醋酸与氨水的反应,写出化学方程式;
(5)根据0.4mol/LNH4Cl与0.2mol/LNaOH反应后的溶液,比较出离子的浓度大小关系。
(1)根据水解反应,HgCl2+H2OHg(OH)Cl+HCl,
a.加水稀释,促进水解,平衡正向移动,不符合题意;
b.增加HCl的浓度,增加生成物的浓度,平衡逆向移动,符合题意;
c.及时移走产物,平衡正向移动,不符合题意;
d.水解是吸热反应,降温平衡逆向移动,符合题意;
(2)非金属性最强元素原子为氯原子,它的最外层轨道排布式为![]() ,该原子核外有1s,2s,2p,3s,3p等5个能级,s轨道是球形的,只有一种空间伸展方向,p轨道是纺锤形的,有三种空间伸展方向,共有4种不同的伸展方向;
,该原子核外有1s,2s,2p,3s,3p等5个能级,s轨道是球形的,只有一种空间伸展方向,p轨道是纺锤形的,有三种空间伸展方向,共有4种不同的伸展方向;
(3)磷原子的最外层电子数为5,氯原子的最外层电子数为7,形成三对共用电子对,剩余一对孤对电子,三氯化磷的电子式为: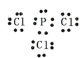 ,PCl3与NH3的沸点高,它们都是分子晶体,虽然氨分子存在氢键,但氨常温下是气体,但三氯化磷常温下是液体,说明范德华力对沸点的影响超过了氢键的影响,两者都是分子晶体,相对分子质量越大,分子间作用力越大,沸点越高,故三氯化磷的的沸点高于氨气;
,PCl3与NH3的沸点高,它们都是分子晶体,虽然氨分子存在氢键,但氨常温下是气体,但三氯化磷常温下是液体,说明范德华力对沸点的影响超过了氢键的影响,两者都是分子晶体,相对分子质量越大,分子间作用力越大,沸点越高,故三氯化磷的的沸点高于氨气;
(4)HN3可用于有机合成,其酸性与醋酸相似,为一元弱酸,若HN3与氨水混合后的化学方程式为HN3+NH3H2O=NH4N3+H2O;
(5)NaOH和NH4Cl反应方程式为NaOH+NH4Cl= NH3H2O +NaCl,NH4Cl溶液浓度是NaOH溶液浓度的2倍,二者等体积混合,根据方程式知,NH4Cl有一半剩余,则溶液中的溶质为等物质的量浓度的NH4Cl、NH3H2O、NaCl,NH4Cl中铵根离子水解程度小于NH3H2O电离程度,导致溶液出碱性,则c(OH)>c(H+),氯离子、钠离子不水解,结合物料守恒知c(Cl)最大,c(NH4+)>c(Na+),NH3H2O是弱电解质,电离程度较小,所以溶液中粒子浓度大小顺序是c(NH4+)>c(Na+)>c(NH3H2O)>c(OH-)>c(H+),答案选D。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。

(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果____________(偏大、偏小或没有影响) 。
【题目】硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性氧化铁为主。经磁选获得精矿,可直接用于高炉炼铁。已知某精矿的主要成分是磁性氧化铁( Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧)。请回答下列问题:
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是________(答案用小数表示,保留3位小数)。
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁____吨(答案保留3位小数)。
(3)煅烧硫铁矿常用富氧空气。从沸腾炉排出的气体成分如下表。如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为_________。
气体 | SO2 | N2 | O2 |
物质的量 | 10 | 58 | 6 |
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为________(最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | I | II | III |
加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为________________。
③若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数)_______________。
【题目】某次实验室制取乙酸丁酯所用原料为:7.4 mL1-丁醇、6.0 mL冰醋酸,1.0mL浓硫酸。
1-丁醇 | 冰醋酸 | |
密度(g/cm3) | 0.81 | 1.05 |
摩尔质量(g/mol) | 74 | 60 |
若制得乙酸丁酯(式量116)的质量为5.12 g,则以下正确的是
A.产率:约54.49%B.产率:约42.04%
C.转化率:冰醋酸小于1-丁醇D.转化率:冰醋酸大于1-丁醇