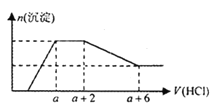
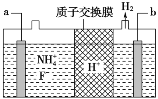
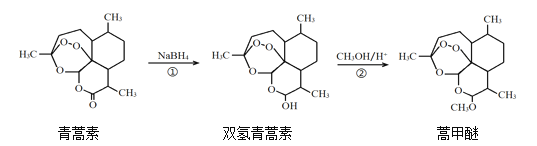
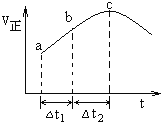
【题目】请回答以下问题
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=________。
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=________。
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10—5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①下列说法正确的是__________
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1molL-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1molL-1 HClO溶液和0.1molL-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO、CO32-、ClO-结合H+的能力由强到弱的顺序为___
③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中:![]() =________
=________
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应10min后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式______。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是________。