题目内容
【题目】某溶液中可能含有SiO32—、OH—、CO32—、SO42—、AlO2—、HCO3—、Na+、Mg2+、Fe3+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
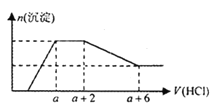
A.原溶液中一定含有Na2SO4
B.反应最后形成的溶液中的溶质只有NaCl
C.原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2
D.原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2—
【答案】D
【解析】
试题分析:根据图像,开始没沉淀,所以原溶液一定有OH—,一定没有HCO3—、Mg2+、Fe3+、Al3+,根据电荷守恒,一定有Na+;沉淀先增多后减少,但不能完全溶解,说明原溶液一定有SiO32—、AlO2—;滴加盐酸体积为![]() ,沉淀的量不变,说明溶液中一定含有CO32—,综合以上溶液可能含有SO42—,故A错误;若原溶液含有SO42—,反应最后形成的溶液中的溶质有NaCl、Na2SO4,故B错误;滴加盐酸体积为
,沉淀的量不变,说明溶液中一定含有CO32—,综合以上溶液可能含有SO42—,故A错误;若原溶液含有SO42—,反应最后形成的溶液中的溶质有NaCl、Na2SO4,故B错误;滴加盐酸体积为![]() ,发生反应为CO32-+2H+=H2O+CO2;
,发生反应为CO32-+2H+=H2O+CO2;![]() ,发生反应为
,发生反应为![]() ,所以CO32- 与AlO2- 的物质的量之比为3∶4,故C错误;原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2—,故D正确。
,所以CO32- 与AlO2- 的物质的量之比为3∶4,故C错误;原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2—,故D正确。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目



