【题目】I.氮和氮的化合物在国防、工农业生产和生活中都有极其广泛的用途。请回答下列问题:
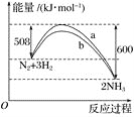
(1)亚硝酰氯(结构式为![]() )是有机合成中的重要试剂,它可由
)是有机合成中的重要试剂,它可由![]() 和
和![]() 在常温常压条件下反应制得,反应方程式为:
在常温常压条件下反应制得,反应方程式为:![]() 。已知几种化学键的键能数据如表所示:
。已知几种化学键的键能数据如表所示:
化学键 |
|
|
|
|
键能 | 243 | 200 | 607 | 630 |
则![]()
![]() ________
________![]() 。
。
(2)在一个恒容密闭容器中充入![]() 和
和![]() 发生(1)中的反应,在温度分别为
发生(1)中的反应,在温度分别为![]() ℃、
℃、![]() ℃时测得
℃时测得![]() 的物质的量(单位:mol)与时间的关系如下表所示:
的物质的量(单位:mol)与时间的关系如下表所示:
t/min 温度 | 0 | 5 | 8 | 13 |
| 2 | 1.5 | 1.3 | 1.0 |
| 2 | 1.15 | 1.0 | 1.0 |
①![]() ________
________![]() (填“
(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
②温度为![]() 时,起始时容器内的压强为
时,起始时容器内的压强为![]() ,则该反应的平衡常数
,则该反应的平衡常数![]() ________(用平衡分压代替平衡浓度计算,分压
________(用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数)(化为最简式)。
物质的量分数)(化为最简式)。
(3)近年来,地下水中的氮污染已成为世界性的环境问题。在金属![]() 、
、![]() 和依(
和依(![]() )的催化作用下,
)的催化作用下,![]() 可高效转化酸性溶液中的硝态氮(
可高效转化酸性溶液中的硝态氮(![]() ),其工作原理如图所示。
),其工作原理如图所示。
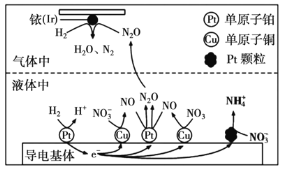
①![]() 表面发生反应的化学方程式为:________。
表面发生反应的化学方程式为:________。
②若导电基体上的![]() 颗粒增多,造成的后果是________。
颗粒增多,造成的后果是________。
Ⅱ.利用电化学原理,将![]() 、
、![]() 和熔融
和熔融![]() 制成燃料电池,模拟工业电解法精炼银,装置如下图所示。
制成燃料电池,模拟工业电解法精炼银,装置如下图所示。
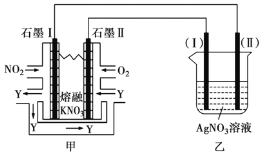
(4)①甲池工作时,![]() 转变成绿色硝化剂
转变成绿色硝化剂![]() ,可循环使用,则石墨Ⅱ附近发生的电极反应方程式为________。
,可循环使用,则石墨Ⅱ附近发生的电极反应方程式为________。
②若用10A的电流电解50min后,乙中阴极得到![]() ,则该电解池的电解效率为________%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为
,则该电解池的电解效率为________%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为![]() )
)