题目内容
【题目】已知![]() 。
。![]() 时,
时,![]() 和
和![]() 的饱和溶液中,金属阳离子的物质的量浓度的负对数
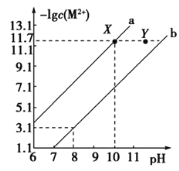
的饱和溶液中,金属阳离子的物质的量浓度的负对数![]() 与溶液pH的变化关系如图所示。下列说法正确的是
与溶液pH的变化关系如图所示。下列说法正确的是
A.向等浓度的![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,
溶液,![]() 先沉淀
先沉淀
B.当![]() 和
和![]() 沉淀共存时,溶液中:
沉淀共存时,溶液中:![]()
C.Y点对应的![]() 分散系是不稳定的体系
分散系是不稳定的体系
D.通过直接控制pH的方法可除去![]() 溶液中含有的量
溶液中含有的量![]()
【答案】C
【解析】
Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则Fe(OH)2的溶解度大于Cu(OH)2,则![]() 相等时,Fe(OH)2中氢氧根离子的浓度大于Cu(OH)2中氢氧根离子的浓度,所以曲线a表示Cu(OH)2、曲线b表示Fe(OH)2,据此分析解答。
相等时,Fe(OH)2中氢氧根离子的浓度大于Cu(OH)2中氢氧根离子的浓度,所以曲线a表示Cu(OH)2、曲线b表示Fe(OH)2,据此分析解答。
A.向等浓度的![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,溶度积小的先沉淀,应先生成氢氧化铜沉淀,故A错误;
溶液,溶度积小的先沉淀,应先生成氢氧化铜沉淀,故A错误;
B.pH=8时,-lgc(Fe2+)=3.1,Ksp[Fe(OH)2]=10-3.1×(10-6)2=10-15.1,当pH=10时,-lgc(Cu2+)=11.7,则Ksp[Cu(OH)2]=10-11.7×(10-4)2=10-19.7,c(Fe2+)∶c(Cu2+)=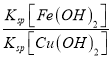 =
=![]() =
=![]() ,故B错误;
,故B错误;
C.Y点对应的Cu(OH)2分散系中,c(Cu2+)×c2(OH-)>Ksp[Cu(OH)2],平衡逆向移动,形成沉淀,即Y点对应的Cu(OH)2分散系是不稳定的体系,故C正确;
D.氢氧化铜溶度积较小,调节pH,先生成氢氧化铜沉淀,不能通过直接控制pH的方法可除去![]() 溶液中含有的量
溶液中含有的量![]() ,故D错误;
,故D错误;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
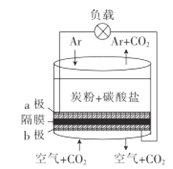
小学生10分钟应用题系列答案【题目】合理处理燃气中的H2S,不仅可减少对大气的污染,还可进行资源化利用。回答下列问题:
(1)H2S和S的燃烧热如表所示,
物质 | 燃烧热/△H(kJmol-1) |
H2S | -a |
S | -b |

请写出常温下H2S与SO2反应的热化学方程式______。
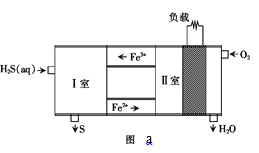
(2)可以把H2S设计为一种燃料电池,原理如图a所示:其中,Fe2+在电池工作中的作用是______;请写出 I室发生的离子方程式______。
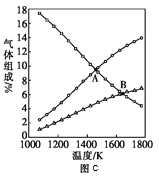
(3)为探究H2S的直接热解2H2S(g)=2H2(g )+S2(g)。在一体积为2L的密闭容器中充入2 mol H2S与1 molAr (起到稀释作用),进行实验。
①某同学测出不同温度下H2S的物质的量与反应时间的图象,图b是截取该图象的中间某部分。请计算T2温度下,0-l0s内,H2S的反应速率v=______moL-1s-1;
②图b中,T1、T2、T3三个温度,最高的是______;比较A点与B点的逆反应速率的大小,vA(逆)______vB(逆)(填“>”、“<”或“=”);
③图c是表示反应2H2S(g)=2H2(g)+S2(g)平衡时,装置内各组分气体物质的量分数=与温度的关系(其中Ar气体变化曲线未画出)。请计算:C点的平衡常数K=______;D点平衡时,H2S的转化率=______。