��Ŀ����
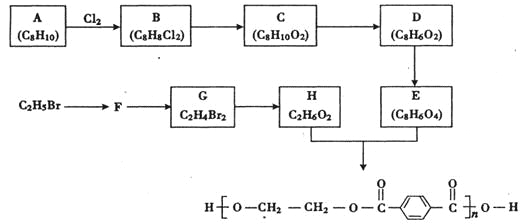
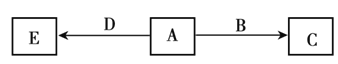
����Ŀ��X��Y��Z��WΪԭ������������������ֶ���������Ԫ�أ�A��B��C��D��EΪ��������Ԫ���е����ֻ���������ɵĻ��������A��C��EΪ�л����֪A����Է�������Ϊ28��B�����к���18�����ӣ�D�����к���10�����ӣ����ֻ�������ת����ϵ����ͼ��ʾ������˵����ȷ����
A.W������������ԭ�Ӱ뾶����Ԫ��
B.Y������������ˮ����Ϊ����
C.X��Y��Z��ɵķ�����ֻ���м��Լ�
D.X��Y��ɵĻ�����ķе�һ����X��Z��ɵĻ�����ķе��
���𰸡�B
��������
X��Y��Z��WΪԭ������������������ֶ���������Ԫ�أ�A��B��C��D��EΪ��������Ԫ���е����ֻ���������ɵĻ��������A��C��EΪ�л��������Ԫ���к���̼Ԫ�أ�D�����к���10�����ӣ���DΪ�⻯�XΪHԪ�أ���֪A����Է�������Ϊ28��B�����к���18�����ӣ��������ֻ�������ת����ϵͼ����AΪC2H4��DΪH2O��EΪ�Ҵ���BΪHCl��CΪ����ϩ�����ԭ��������С��֪��YΪC��ZΪO��WΪClԪ�أ��ݴ˷������
���ݷ�����֪��XΪHԪ�أ�YΪCԪ�أ�ZΪOԪ�أ�WΪClԪ�ء�
A��ͬһ���ڴ�������ԭ�Ӱ뾶��С��ClԪ��λ�ڵ������ڣ�����������ԭ�Ӱ뾶����ΪNa����A����
B��C������������ˮ����Ϊ̼�ᣬ̼��Ϊ���ᣬ��B��ȷ��
C��H��C��O�γɵ��Ҵ��к���C-C�Ǽ��Լ�����C����
D��H��C�γɵĻ�����Ϊ����X��Z�ɵĻ�����ΪHCl��̼ԭ�����϶����������Ϊ��̬����е����HCl����D����
��ѡB��

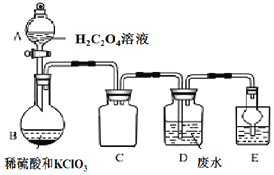
����Ŀ���Ȼ���ͭ��![]() ���������л��ϳɹ�ҵ�еĴ�������һ�ְ�ɫ��ĩ������ˮ���������Ҵ���ϡ���ᡣ��ҵ��������ӡˢ��·�ķ�Һ����
���������л��ϳɹ�ҵ�еĴ�������һ�ְ�ɫ��ĩ������ˮ���������Ҵ���ϡ���ᡣ��ҵ��������ӡˢ��·�ķ�Һ����![]() ��
��![]() ��
��![]() ��
��![]() ������
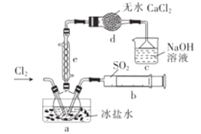
������![]() ��������ͼ��ʾ��
��������ͼ��ʾ��
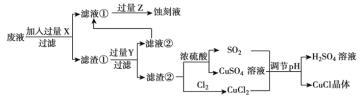
����������Ϣ�ش��������⣺
��1�����������У�X��________��Z��________�������ѧʽ��
��2��д������![]() �����ӷ���ʽ________��
�����ӷ���ʽ________��
��3��������![]() ���岻��ˮ������ˮ�Ҵ�ϴ�ӵ�ԭ����________��
���岻��ˮ������ˮ�Ҵ�ϴ�ӵ�ԭ����________��
��4����![]() �����ɹ����������ϲ���Ҫ����SO2���壬��������________��
�����ɹ����������ϲ���Ҫ����SO2���壬��������________��
��5����֪��������![]() ��
��![]() ������
������![]() ������Һ�м���
������Һ�м���![]() ������
������![]() ����ʱ��Һ��
����ʱ��Һ��![]() =________��
=________��
��6��ʵ��̽��pH��![]() ���ʵ�Ӱ�����±���ʾ��
���ʵ�Ӱ�����±���ʾ��
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 70 | 90 | 82 | 78 | 75 | 72 | 70 |
����![]() �������pHΪ________����pH�ϴ�ʱ
�������pHΪ________����pH�ϴ�ʱ![]() ���ʱ�͵�ԭ����________��
���ʱ�͵�ԭ����________��
����Ŀ���������Լ����Թ��е����ʲ��������Ӧʵ��Ŀ�ĵ���
ʵ��Ŀ�� | �Լ� | �Թ��е����� |
| |
A | ����̼���ƺ�̼�����ƹ��� | ϡ���� | ��̼���Ƣ�̼������ | |
B | �Ƚ� | ��ˮ | �� | |
C | ֤����������û��̼̼˫�� |
| �ٱ��ڼ�ϩ | |
D | ̽���Ӵ�����Է�Ӧ���ʵ�Ӱ�� | VmL�� | ��ag����ʯ���ag����ʯ�� |
A.AB.BC.CD.D