【题目】CO、SO2是常见的大气污染物,应用化学原理变废为宝,意义重大。
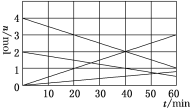
(1)CO与SO2用铝矾土作催化剂、475 ℃条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应过程中各组分的物质的量与反应时间的关系如图所示,该反应的化学方程式为________。
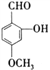
(2)利用CO可以合成新能源物质——甲醇。其原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在压强分别为p1、p2,体积均为V L的两个容器中充入a mol CO、2a mol H2,在催化剂作用下反应生成甲醇,平衡时转化率与温度、压强的关系有下表数据:
CH3OH(g) ΔH。在压强分别为p1、p2,体积均为V L的两个容器中充入a mol CO、2a mol H2,在催化剂作用下反应生成甲醇,平衡时转化率与温度、压强的关系有下表数据:
50 ℃ | 100 ℃ | 200 ℃ | 300 ℃ | 400 ℃ | |
p1 | 0.65 | 0.50 | 0.40 | 0.32 | 0.24 |
p2 | 0.80 | 0.70 | 0.65 | 0.50 | 0.41 |
①ΔH________0,p1________p2。(填“>”“<”或“=”)。
②压强为p2,温度为300 ℃时,该反应的平衡常数K=________。
③压强为p1,温度为100 ℃时,达到平衡后,继续向其中通入0.5a mol CO、a mol H2、0.5a mol CH3OH,则平衡时CH3OH的体积分数________(填“增大”“减小”或“不变”)。
④下列说法正确的是________。
a.当n(CO)∶n(H2)∶n(CH3OH)=1∶2∶1时,可逆反应达到平衡状态
b.平衡后向体积为V L的容器内继续充入He,平衡不移动
c.使用新型催化剂,可提高CO的平衡转化率
(3)MnO2悬浊液、NaOH溶液都是SO2气体常用的吸收剂。
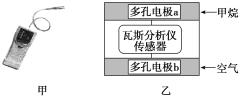
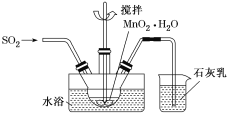
①已知MnO2+SO2=MnSO4,吸收SO2的装置如图所示。反应过程中,为使SO2尽可能转化完全,可采取的合理措施有___________、__________。
②将标准状况下4.48 L SO2气体缓缓通入100 mL 3 mol·L-1 NaOH溶液中,充分反应后c(Na+)=___ (填几种粒子浓度之和)。
③取②中所得溶液10 mL,加水稀释成1 L,向其中加入CaCl2固体至有沉淀CaSO3(Ksp=3.1×10-7)生成,则所加CaCl2固体的质量为_____mg。
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D