【题目】工业制硫酸的尾气中含有一定量SO2,处理尾气的手段除了氨吸收法以外还有以下几种方法。
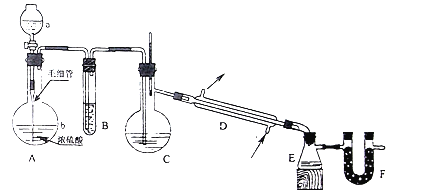
(一)工业实际吸收过程中,第Ⅰ步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氟化后制得产品A。
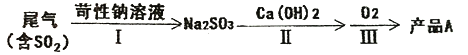
(1)产品A是_______(填化学式)。
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?_______(填“可以”、“不可以”或“不确定”)原因是_______。
(二)制备MnSO4H2O:SO2还原MnO2矿制备MnSO4H2O,过程如下:

己知25℃时部分物质的溶度积常数如下表:
物质 | Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | MnS | FeS | CuS |
溶度积 | 2.1×10-13 | 4.0× 10-38 | 2.2×10-23 | 1.0×10-11 | 6.3×10-18 | 6.3×10-38 |
(3)还原时,若尾气中SO2含量为4.48%,除去标况下lm3尾气至少需要含锰质量分数为55%的MnO2 矿粉_______g。
(4)除铁时加入碳酸钙,发生的反应的离子反应方程式为_____________________。
(5)试剂A最好是______________(写化学式)。
(6)操作I的名称为_________________。MnSO4H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是________________。