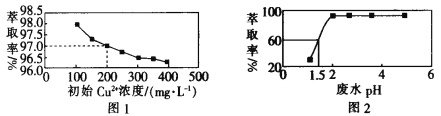
题目内容
【题目】铜及其化合物具有广泛的应用,间接碘量法可以测定铜合金中的铜,回答下列问题:
(1)铜合金的种类较多,主要有黄铜和各种青铜等。试样可以用HNO3分解,还需要用到浓H2SO4.CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为______;S、O、N三种元素的第一电离能由大到小的顺序为______;
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2,其中NH3中心原子的杂化轨道类型为______,[Cu(NH3)4](NO3)2属于______晶体。
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1 mol CN-中含有的π键数目为______,与CN-互为等电子体的离子有______(写出一种即可);
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是______;
(5)在弱酸性溶液中,Cu2+与过量KI作用,生成CuI沉淀,同时析出定量的I2;如图为碘晶体晶胞结构。下列有关说法中正确的是______;
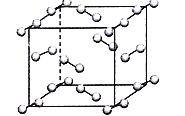
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子,以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
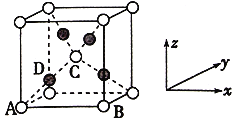
(6)已知Cu2O晶胞结构如图所示,该晶胞原子坐标参数A为(0,0,0),B为(1,0,0),C为(![]() )。则D原子的坐标参致为______,它代表______原子(填元素符号);已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12,Cu原子的空间利用率是______。
)。则D原子的坐标参致为______,它代表______原子(填元素符号);已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12,Cu原子的空间利用率是______。
【答案】1s22s22p63s23p63d9 N>O>S sp3 离子 2NA ![]() CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高 A (
CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高 A (![]() ,
,![]() ,
,![]() ) Cu 74%
) Cu 74%
【解析】
(1)阳离子为Cu 2+,Cu原子核外电子数为29,原子形成阳离子时,先失去高能层中电子,同一能层先失去高能级中电子;同主族自上而下元素第一电离能减小,N元素原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的;
(2)NH3中N原子形成3个N-H,含有1对孤对电子,VSEPR模型为四面体;[Cu(NH3)4](NO3)2由[Cu(NH3)4]2+ 与NO3-构成,是离子化合物;
(3)CN-与N2互为等电子体,CN-中C、N之间形成C≡N三键,三键含有1个σ键、2个π键;将N原子用碳原子与1个单位负电荷替换可得到与CN-互为等电子体的一种离子;
(4)离子电荷越多,晶格能越大,物质的熔点越高;
(5)同种非金属元素之间形成非极性共价键,碘为分子晶体,碘晶体中的碘原子间存在非极性键和范德华力,晶胞中占据顶点和面心,碘分子的排列有2种不同的取向;
(6)晶胞原子坐标参数A为(0,0,0)、B为(1,0,0)、C为(![]() ,
,![]() ,
,![]() ),如图坐标系中,A为处于坐标系中的原点(定义为O),则C处于晶胞体心位置,A、D、C的连线处于体对角线线上,且D处于A、C连线的中点位置,D到晶胞左侧面距离为参数x,D到晶胞前面的距离为参数y,D到晶胞下底面距离为参数z;计算晶胞中白色球、黑色球数目,结合化学式确定代表的元素;金属铜是面心立方最密堆积方式,Cu原子处于顶点与面心,顶点Cu原子与面心Cu原子相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用;设Cu原子半径为r,则晶胞棱长为2
),如图坐标系中,A为处于坐标系中的原点(定义为O),则C处于晶胞体心位置,A、D、C的连线处于体对角线线上,且D处于A、C连线的中点位置,D到晶胞左侧面距离为参数x,D到晶胞前面的距离为参数y,D到晶胞下底面距离为参数z;计算晶胞中白色球、黑色球数目,结合化学式确定代表的元素;金属铜是面心立方最密堆积方式,Cu原子处于顶点与面心,顶点Cu原子与面心Cu原子相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用;设Cu原子半径为r,则晶胞棱长为2![]() r,计算晶胞中Cu原子总体积,该晶胞中Cu原子的空间利用率。
r,计算晶胞中Cu原子总体积,该晶胞中Cu原子的空间利用率。
(1)阳离子为Cu 2+,Cu原子核外电子数为29,阳离子的基态核外电子排布式为:1s22s22p63s23p63d9;由元素周期律可知,同主族自上而下元素第一电离能减小,N元素原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能为:N>O>S;
(2)NH3中N原子形成3个N-H,含有1对孤对电子,杂化轨道数目为4,VSEPR模型为四面体,中心N原子采取sp3杂化;[Cu(NH3)4]2+ 与NO3-形成离子化合物,则[Cu(NH3)4](NO3)2属于离子晶体;
(3)CN-与N2互为等电子体,CN-中C、N之间形成C≡N三键,三键含有1个σ键、2个π键,1mol CN中含有的2molπ键,1mol CN中含有的π键数目为:2NA;将N原子用碳原子与1个单位负电荷替换可得到与CN-互为等电子体的一种离子:![]() ;
;
(4)CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;
(5)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.用均摊法计算:顶点碘分子个数加面心碘分子个数=8×![]() +6×
+6×![]() =4,因此平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误;
=4,因此平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误;
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.碘晶体中的碘原子间存在I-I非极性键,而晶体中碘分子之间存在范德华力,故D错误;
故答案为:A;
(6)晶胞原子坐标参数A为(0,0,0)、B为(1,0,0)、C为(![]() ,
,![]() ,
,![]() ),如图坐标系中,A为处于坐标系中的原点(定义为O),则C处于晶胞体心位置,A、D、C的连线处于体对角线线上,且D处于A、C连线的中点位置,故D到晶胞左侧面距离为
),如图坐标系中,A为处于坐标系中的原点(定义为O),则C处于晶胞体心位置,A、D、C的连线处于体对角线线上,且D处于A、C连线的中点位置,故D到晶胞左侧面距离为![]() 、到晶胞前面的距离为
、到晶胞前面的距离为![]() ,到晶胞下底面距离为
,到晶胞下底面距离为![]() ,故D的参数为(
,故D的参数为(![]() ,
,![]() ,
,![]() );晶胞中白色球数目=1+8×
);晶胞中白色球数目=1+8×![]() =2,黑色球数目=4,二者数目之比为1:2,而化学式为Cu2O,故黑色球为Cu原子、白色球为O原子,即D表示Cu原子;金属铜是面心立方最密堆积方式,Cu原子处于顶点与面心,顶点Cu原子与面心Cu原子相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用,设Cu原子半径为r,则晶胞棱长为2
=2,黑色球数目=4,二者数目之比为1:2,而化学式为Cu2O,故黑色球为Cu原子、白色球为O原子,即D表示Cu原子;金属铜是面心立方最密堆积方式,Cu原子处于顶点与面心,顶点Cu原子与面心Cu原子相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用,设Cu原子半径为r,则晶胞棱长为2![]() r,晶胞体积=(2
r,晶胞体积=(2![]() r)3,晶胞中Cu原子数目=8×
r)3,晶胞中Cu原子数目=8×![]() +6×
+6×![]() =4,晶胞中Cu原子总体积=4×
=4,晶胞中Cu原子总体积=4×![]() πr3,该晶胞中Cu原子的空间利用率是=
πr3,该晶胞中Cu原子的空间利用率是=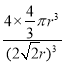 ×100%=74%。
×100%=74%。

 阅读快车系列答案
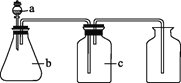
阅读快车系列答案【题目】下图中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
A. AB. BC. CD. D