题目内容
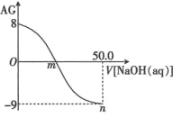
【题目】一定温度下,用水吸收SO2气体时,溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中![]() =________;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
=________;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
【答案】向左 400 HCO3-+SO2=HSO3-+CO2
【解析】
向水中加入能电离出氢离子或氢氧根离子的物质抑制水的电离;SO2与水反应产生亚硫酸,亚硫酸电离产生H+,根据H2SO3的电离平衡常数分析计算;根据强酸与弱酸盐反应制取弱酸书写反应的离子方程式。
二氧化硫和水反应生成亚硫酸,亚硫酸电离生成氢离子导致溶液中氢离子浓度增大,从而抑制水电离,即水的电离平衡向逆反应方向移动;亚硫酸的电离平衡方程式为H2SO3![]() H++HSO3-,若得到pH=4的H2SO3溶液,c(H+)=10-4 mol/L,由于Ka2=
H++HSO3-,若得到pH=4的H2SO3溶液,c(H+)=10-4 mol/L,由于Ka2= =2.5×10-7,所以
=2.5×10-7,所以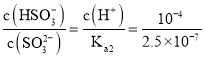 =400;
=400;
由于Ka1(H2SO3)> Ka1(H2CO3)> Ka2(H2SO3),所以SO2通入小苏打溶液,反应产生NaHSO3和CO2,反应的离子方程式是HCO3-+SO2=HSO3-+CO2。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
【题目】下列实验对相应的现象解释不正确的是
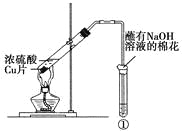
选项 | ①中试剂 | ①中现象 | 解释 |
A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
A.AB.BC.CD.D