【题目】.甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2 及 HI 为原料来合成。请回答下列问题:
(1)制取甲胺的反应为 CH3OH(g)+NH3(g)==CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:
共价键 | C-O | H-O | N-H | C-N |
键能/(kJ | 351 | 463 | 393 | 293 |
则该反应的△H=_____kJ·mol-1
(2)工业上利用水煤气合成甲醇的反应为 CO(g)+2H2(g) ![]() CH3OH(g) △H<0。一定温度下, 向体积为 2L 的密闭容器中加入 CO 和 H2,5min 末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下, 向体积为 2L 的密闭容器中加入 CO 和 H2,5min 末反应达到化学平衡状态,测得各组分浓度如下表所示。
物质 | CO | H2 | CH3OH |
浓度/(mol | 0.9 | 1.0 | 0.6 |
①0~5min 内,用 CO 表示的平均反应速率为_____。
②既能加快反应速率,又能提高氢气转化率的措施有_____(答一条即可)。
③能说明上述反应已达化学平衡状态的是_____(填字母)。
A.v正 (CO)=2v逆 (H2)
B.混合气体密度保持不变
C.反应容器内压强保持不变
D.混合气体的平均摩尔质量不变
(3)PbI2 可由 Pb3O4 和 HI 反应制备,反应的化学方程式为_____。
(4)常温下 PbI2 饱和溶液中 c(I-)=2.0×10-3mol·L-1,则 Ksp(PbI2)=________;已知Ksp(PbS)=4.0×10-28,则反应 PbI2(s)+2-(aq) ![]() PbS(s)+2I-(aq)的平衡常数K=_______________________。
PbS(s)+2I-(aq)的平衡常数K=_______________________。
(5)HI 的分解反应曲线和液相法制备 HI 的反应曲线分别如图 1 和图 2 所示:
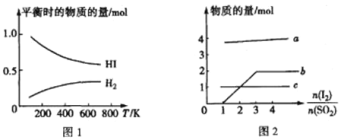
①反应 H2(g)+I2(g)![]() 2HI(g)的△H__________(填“>”或“<")0。
2HI(g)的△H__________(填“>”或“<")0。
②将 SO2 通入碘水中会发生反应:SO2+I2+2H2O==4H++SO42-+2I-,I2+I- ![]() I3-。图 2 中曲线 b 所代表的微粒是_____(填微粒符号)。
I3-。图 2 中曲线 b 所代表的微粒是_____(填微粒符号)。