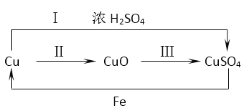
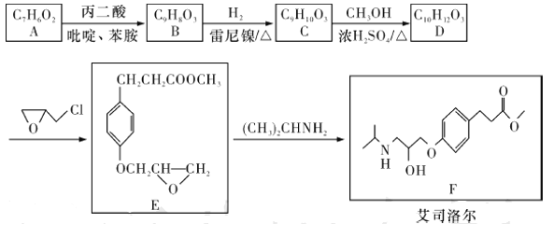
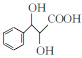
题目内容
【题目】四甲基氢氧化铵[(CH3)4NOH]是一元强碱。常温下,向20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是
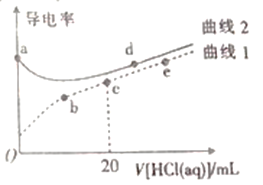
A. 在a、b、c、d、e中,水电离程度最大的点是d
B. c点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
C. 曲线I中c与e之间某点溶液呈中性
D. a点溶液pH=12
【答案】B
【解析】
A.由图像知,曲线1导电性较弱,说明曲线I对应的溶液为弱电解质溶液,即曲线I代表氨水,曲线2代表四甲基氢氧化铵,c点表示氨水与盐酸恰好完全反应生成氯化铵,水解程度最大,故此点对应的溶液中水的电离程度最大,故A错误;
B.c点表示溶质是氯化铵,质子守恒式为c(H+)=c(OH-)+c(NH3H2O),故B正确;
C.在氨水中滴加盐酸,溶液由碱性变中性,再变成酸性,滴定前氨水呈碱性,而c点对应的溶液呈酸性,说明中性点在c点向b点间的某点,c点到e点溶液的酸性越来越强,故C错误;
D.依题意,四甲基强氧化铵是一元强碱,c (OH-)=0.1molL-1,c(H+)=1×10-13 molL-1,pH=-lg c(H+)=13,故D错误。
故选B。

【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的