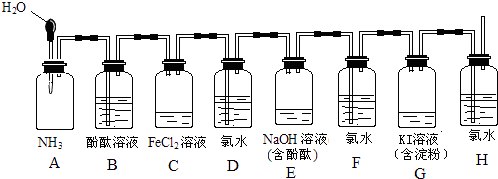
��Ŀ����
����Ŀ����������Ҫ�ɷ�Al2O3���������� SiO2��Fe2O3���ʡ�������ͼ�Ʊ�����
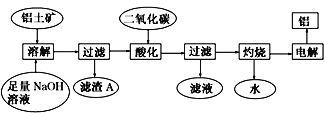
��֪ 2Na2SiO3+2NaAlO2+2H2O === Na2Al2Si2O8��+4NaOH�� �ش��������⣺
��1���ڹ������̵��岽�У����������ʵ���������ƾ��ơ�����������ǯ��������֮�⣬����Ҫ_____________��_________________________��
��2��Na2Al2Si2O8����������ʽΪ_________________________��
��3������A���ಽ���Ƶôֹ� ����д���ɶ��������Ƶôֹ�Ļ�ѧ����ʽ________________��
��4���ڹ������̵������У�ͨ������Ķ�����̼ʱ���÷�Ӧ�����ӷ���ʽ��_______________�� �õ�����Һ������Ba(OH)2��Һ��Ӧ����Ҫ���ӷ���ʽΪ ____________________��
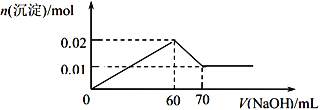
��5����a g����������һϵ�в���֮�����յõ�b g Al��������ʵ������в��������������� ����˵����ȷ����____________�� ��NA��ʾ�����ӵ�������
A.�������� Al3+��ĿС��![]()
B.��������Al2O3���ʵ���С��b/54 mol
C.����������Ԫ�ص���������Ϊ![]() ��100�G
��100�G
���𰸡� ������ ���ż� Na2O��Al2O3��2SiO2 SiO2+2C![]() Si+2CO�� AlO2��+CO2+2H2O == Al(OH)3��+ HCO3- Ba2++OH-+HCO3-== BaCO3��+ H2O A
Si+2CO�� AlO2��+CO2+2H2O == Al(OH)3��+ HCO3- Ba2++OH-+HCO3-== BaCO3��+ H2O A
�����������������Ҫ�ɷ���Al2O3����������SiO2��Fe2O3�����ʣ������������������ƣ�������������������NaOH��Һ��Ӧ�������κ�ˮ��ֻ������������Ӧ�������Ϣ��֪������Na2Al2Si2O8���������˺������AΪFe2O3��Na2Al2Si2O8����Һ�ö�����̼�ữʱ����NaAlO2��ȫת��ΪAl(OH)3����Ӧ�����ӷ���ʽΪ��AlO2��+CO2+2H2O��Al(OH)3��+HCO3�������˵������������������յ�������������������õ���������
��1���������������ʵ���������ƾ��ơ�����������ǯ��������֮�⣬����Ҫ�����������żܡ���2�����ݻ�ѧʽNa2Al2Si2O8��֪����������ʽΪNa2O��Al2O3��2SiO2����3��������̼��������跴Ӧ�Ƶôֹ�Ļ�ѧ����ʽΪSiO2+2C![]() Si+2CO������4���������Ϸ�����֪ͨ������Ķ�����̼ʱ���÷�Ӧ�����ӷ���ʽΪAlO2��+CO2+2H2O��Al(OH)3��+HCO3�����õ�����Һ�к���̼�����ƣ�������Ba(OH)2��Һ��Ӧ����Ҫ���ӷ���ʽΪBa2++OH-+HCO3-==BaCO3��+H2O����5��A�����������ȫ������������ɣ��������ӵ����ʵ�����
Si+2CO������4���������Ϸ�����֪ͨ������Ķ�����̼ʱ���÷�Ӧ�����ӷ���ʽΪAlO2��+CO2+2H2O��Al(OH)3��+HCO3�����õ�����Һ�к���̼�����ƣ�������Ba(OH)2��Һ��Ӧ����Ҫ���ӷ���ʽΪBa2++OH-+HCO3-==BaCO3��+H2O����5��A�����������ȫ������������ɣ��������ӵ����ʵ�����![]() �����ڻ��������ʣ�������������Al3+��ĿС��
�����ڻ��������ʣ�������������Al3+��ĿС��![]() ��A��ȷ��B��bg�������ʵ�����b/27mol�����ڻ���Na2Al2Si2O8�������������ԭ���غ��֪�������������������ʵ�������b/54mol��B������C�����ڻ���Na2Al2Si2O8������������������Ԫ�ص�������������
��A��ȷ��B��bg�������ʵ�����b/27mol�����ڻ���Na2Al2Si2O8�������������ԭ���غ��֪�������������������ʵ�������b/54mol��B������C�����ڻ���Na2Al2Si2O8������������������Ԫ�ص�������������![]() ��100�G��C����ѡA��
��100�G��C����ѡA��