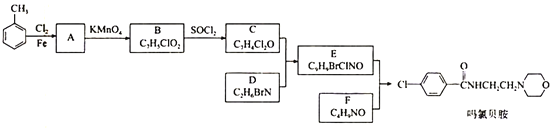
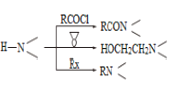
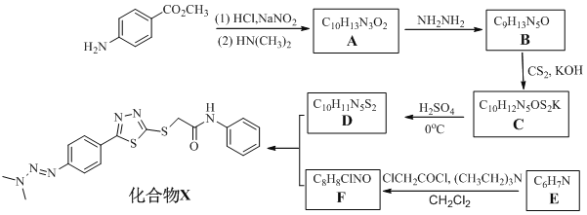
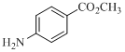
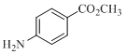
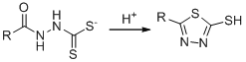【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的__________________区;溴的价电子排布式为______________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2 形式存在的。使氢氟酸分子缔合的作用力是____________________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____________________(写出 名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图 a、b 所示:
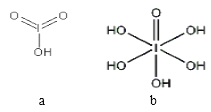
请比较二者酸性强弱:HIO3______________________H5IO6(填“>”、 “<”或“=”)。
(5)已知 ClO2-为 V 形,中心氯原子周围有四对价层电子。 ClO2-中心氯原子的杂化轨道类型为___________________,写 出一个 ClO2-的等电子体______________________。
(6)如图为碘晶体晶胞结构。有关说法中正确的是______________________。
A.碘分子的排列有 2 种不同的取向,2 种取向不同的碘分子 以 4 配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有 4 个碘原子
C.碘晶体中微粒(碘分子)的堆积为最密堆积
D.碘晶体中存在的相互作用有非极性键和范德华力
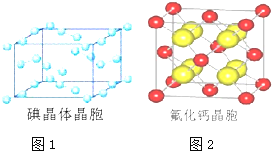
(7)已知 CaF2 晶体(见图)的密度为ρg/cm3,NA 为阿伏加德罗常数,棱上相邻的两个 Ca2+ 的核间距为 a cm, 则 CaF2 的相对分子质量可以表示为__________________。
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业 和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期 IIIA 族,化学性质与铝元素相似。
(1)如图是当反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,反应达到平衡时,混合物中 NH3的物质的量分数随压强的变化曲线。
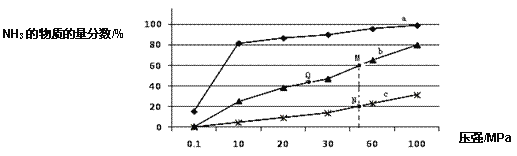
①曲线 a 对应的温度是_____________。
②关于工业合成氨的反应,下列叙述正确的是____________(填字母)。
A.及时分离出 NH3 可以提高 H2 的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中 M、N、Q 点平衡常数 K 的大小关系是 K(M) = K(Q) >K(N)
③M 点对应的 H2 转化率是____________。
(2)工业上利用 Ga 与 NH3 合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成 3 mol H2 时就会放出30.8 kJ 的热。
①该反应的热化学方程式是____________________。
②反应的化学平衡常数表达式是____________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是____________。
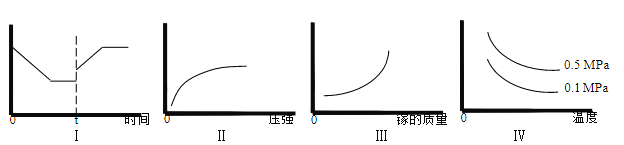
A.I 图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温
B.II 图像中纵坐标可以为镓的转化率
C.III 图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的 NaOH 溶液中,该反应的离子方程式是:___________________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液 X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数 Ka | 2×10- 11 | 1×10- 7 |
碱式电离常数 Kb | 1.3×10- 33 | 1.4×10- 34 |
往 X 溶液中缓缓通入 CO2,最先析出的氢氧化物是____________。
(4)工业上以电解精炼法提炼镓的原理如下:以待提纯的粗镓(内含 Zn、Fe、Cu 杂质)为阳极,以高纯镓为阴极,以 NaOH 水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技 术到达阴极并在阴极放电析出高纯镓。
①己知离子氧化性顺序为:Zn2+<Ga3+< Fe2+<Cu2+,电解精炼镓时阳极泥的成分是____________。
②GaO2- 在阴极放电的电极方程式是___________。