题目内容
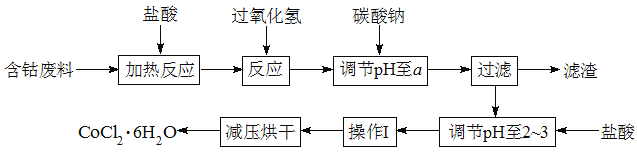
【题目】CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110 ~120℃时,失去结晶水变成有毒的无水氯化钴。
③物质的熔沸点随压强降低而降低
④乙醚沸点为34.6℃
⑤部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,从环保角度分析其主要优点为_______________________。
(2)加入碳酸钠调节pH至a ,a的范围是____________________________。
(3)操作Ⅰ包含3个实验基本操作,它们依次是_____________、______________和过滤。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是____________________________。
(5)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,通过过滤除去不溶性杂质后,再进行_________(填操作名称)。
(6)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______________。(答出一个原因即可)
【答案】(1)减少氮氧化物的排放,防止大气污染;(2)5.2~7.6;(3)蒸发浓缩、冷却结晶;(4)降低烘干温度,防止产品分解,变成有毒的无水氯化钴;(5)蒸馏;(6)样品中含有NaCl杂质(或烘干时失去了部分结晶水)
【解析】
试题分析:(1)硝酸做氧化剂,其还原产物是氮的氧化物,氮的氧化物对环境有危害,因此减少氮氧化物的排放,防止大气污染;(2)调节pH,使杂质转化成沉淀沉降出来,因此pH控制在5.2~7.6;(3)得到含结晶水的物质,因此采用蒸发浓缩、冷却结晶、过滤的方法;(4) 产物带有结晶水以及题目中信息,降低烘干温度,防止产品分解,变成有毒的无水氯化钴;(5)CoCl2·6H2O易溶于乙醚,利用其沸点不同,采用蒸馏方法提纯;(6)造成质量分数大于100%,可能是样品中含有NaCl杂质或者烘干时失去部分结晶水。

 阅读快车系列答案
阅读快车系列答案