题目内容
【题目】常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
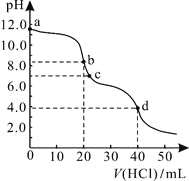
A. a点溶液呈碱性的原因用离子方程式表示为:CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
C. 滴定过程中使用甲基橙作为指示剂比酚酞更准确
D. d点处溶液中水电离出的c(H+)大于b点处
【答案】B
【解析】试题分析:A. a点溶液中的溶质为碳酸钠,碳酸钠水解溶液显碱性,碳酸钠的水解分步进行,故A错误;B. c点溶液呈中性,电荷守恒有c(Na+)+ c(H+)=c(Cl-)+ c(HCO![]() )+2c(CO
)+2c(CO![]() )+ c(OH-),因为c(H+)=c(OH-),所以c(Na+)=c(Cl-)+ c(HCO
)+ c(OH-),因为c(H+)=c(OH-),所以c(Na+)=c(Cl-)+ c(HCO![]() )+2c(CO
)+2c(CO![]() ),即c(Na+)-c(Cl-)=c(HCO
),即c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() ),故B正确;C. 根据图像,滴定终点有2个,1个在pH等于8左右,应该选用酚酞作指示剂,1个在pH等于4左右,应该选用甲基橙作指示剂,故C错误;D. d点溶液显酸性,是碳酸的电离导致的,水的电离受到抑制,b点处溶液显碱性,是碳酸氢钠水解导致的结果,水的电离受到促进,因此b点处溶液中水电离出的c(H+)大于d点,故D错误;故选B。
),故B正确;C. 根据图像,滴定终点有2个,1个在pH等于8左右,应该选用酚酞作指示剂,1个在pH等于4左右,应该选用甲基橙作指示剂,故C错误;D. d点溶液显酸性,是碳酸的电离导致的,水的电离受到抑制,b点处溶液显碱性,是碳酸氢钠水解导致的结果,水的电离受到促进,因此b点处溶液中水电离出的c(H+)大于d点,故D错误;故选B。

练习册系列答案
相关题目