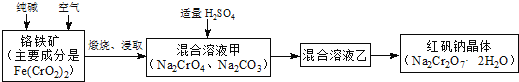
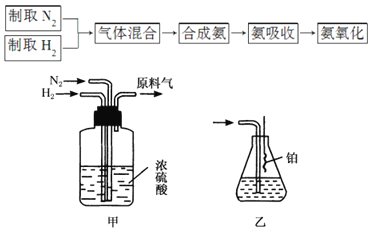
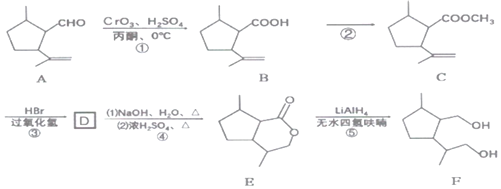
【题目】合成氨对化学工业和国防工业具有重要意义。
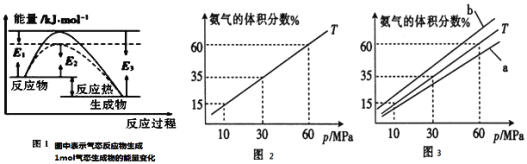
(1)根据图1请写出合成氨的热化学方程式______![]() 热量用
热量用![]() 、
、![]() 或
或![]() 表示
表示![]() 。
。
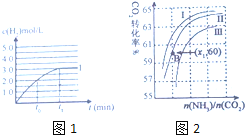
(2)向合成塔中按物质的量之比l:4充入![]() 、
、![]() 进行氨的合成,图2为
进行氨的合成,图2为![]() 时平衡混合物中氨气的体积分数与压强
时平衡混合物中氨气的体积分数与压强![]() 的关系图。
的关系图。
①图2中氨气的体积分数为![]() 时,
时,![]() 的转化率为______。
的转化率为______。
②图3中![]() ,则温度为
,则温度为![]() 时对应的曲线是______
时对应的曲线是______![]() 填“a”或“b”
填“a”或“b”![]() 。
。
(3)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为![]() ,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
时间 |
|
|
|
|
0 |
|
| 0 | 0 |
5 |
|
|
|
|
7 |
|
|
|
|
10 |
|
|
|
|
①分析表中数据,判断5min时反应是否处于平衡状态?______![]() 填“是”或“否”
填“是”或“否”![]() ,前5min反应的平均反应速率
,前5min反应的平均反应速率![]() ______。
______。
②在相同实验条件下,若改为加入![]() ,若要求平衡后
,若要求平衡后![]() 在反应混合气中质量分数不变,则还需加入的物质及其物质的量为______。
在反应混合气中质量分数不变,则还需加入的物质及其物质的量为______。
③反应在![]() 内,CO的物质的量减少的原因可能是______
内,CO的物质的量减少的原因可能是______![]() 填字母
填字母![]() 。
。
![]() 减少
减少![]() 的物质的量
的物质的量 ![]() 降低温度
降低温度 ![]() 升高温度
升高温度 ![]() 充入
充入![]()
④下列方法中可以证明上述已达平衡状态的是______。
![]() 单位时间内生成
单位时间内生成![]() 的同时生成
的同时生成![]()
b.容器内压强不再变化
![]() 混合气体密度不再变化
混合气体密度不再变化
![]() 混合气体的平均相对分子质量不再变化
混合气体的平均相对分子质量不再变化
![]() 的质量分数不再变化
的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值![]() 如表:
如表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
则反应![]() 在900K时,该反应平衡常数的对数值
在900K时,该反应平衡常数的对数值![]() ______。
______。
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。利用处理后的废旧锂离子电池材料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)制备CoO,工艺流程如图:
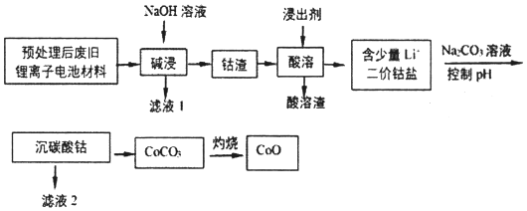
回答下列问题:
(1)Co元素在元素周期表中的位置___。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极回收的原因是___;提高“碱浸”效率的措施有____(至少写两种)。
(3)不同浸出剂“酸溶”结果如表:
出剂 | 浸出液化学成分/(gL-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCl | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
①浸出剂(a)的钴浸出率最高,而实际工艺中一般不选用浸出剂(a)的原因是____。
②温度越高浸出反应速率越快,所以“酸溶”一般选用较高的温度。据此你选择的浸出剂是___(填序号),理由是___。
③从氧化还原角度分析,还原等物质的量的Co3O4,需要___(填“H2O2”或“Na2S2O3”)物质的量更少。
④综上分析,写出最合适的浸出剂与Co3O4反应的化学方程式____。
(4)已知:Ksp[Co(OH)2]=1.0×10-15,Ksp(Li2CO3)=1.7×10-3,Ksp(CoCO3)=1.5×10-13。若滤液2中Co2+含量为5.9×10-2gL1,计算判断“沉碳酸钴”应调节pH不高于____。