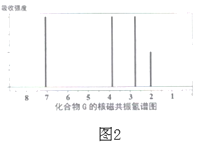
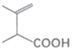
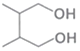
题目内容
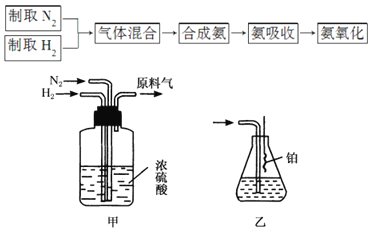
【题目】实验室模拟合成氨和氨催化氧化的流程如图:
(1)N元素在周期表中位置______。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合、干燥,还有______作用。
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热,锥形瓶中还可观察到的现象是______。
(4)写出乙装置中氨氧化的化学方程式:______。
【答案】第二周期第VA族 控制氢气和氮气的流速从而控制气体体积比 有红棕色气体产生 ![]()

![]()
【解析】
(1)氮元素核电荷数7,核外有2个电子层,最外层电子数5,位于周期表中的第二周期第VA族;
(2)氮气和氢气通过甲装置,甲装置中的浓硫酸可以将氮气和氢气干燥,同时可以根据甲装置中冒气泡的速率来控制气体流量,从而控制气体体积比;
(3)氨的催化氧化反应是一个放热反应,放出的热使铂丝保持红热,生成的一氧化氮与空气中的氧气化合成二氧化氮,二氧化氮是红棕色气体;
(4)氨的催化氧化生成一氧化氮和水,反应方程式为![]()

![]() 。
。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】合理处理燃气中的H2S,不仅可减少对大气的污染,还可进行资源化利用。回答下列问题:
(1)H2S和S的燃烧热如表所示,
物质 | 燃烧热/△H(kJmol-1) |
H2S | -a |
S | -b |
请写出常温下H2S与SO2反应的热化学方程式______。
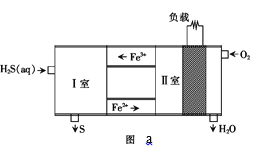
(2)可以把H2S设计为一种燃料电池,原理如图a所示:其中,Fe2+在电池工作中的作用是______;请写出 I室发生的离子方程式______。
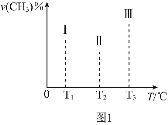
(3)为探究H2S的直接热解2H2S(g)=2H2(g )+S2(g)。在一体积为2L的密闭容器中充入2 mol H2S与1 molAr (起到稀释作用),进行实验。
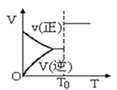
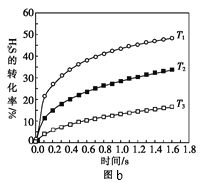
①某同学测出不同温度下H2S的物质的量与反应时间的图象,图b是截取该图象的中间某部分。请计算T2温度下,0-l0s内,H2S的反应速率v=______moL-1s-1;
②图b中,T1、T2、T3三个温度,最高的是______;比较A点与B点的逆反应速率的大小,vA(逆)______vB(逆)(填“>”、“<”或“=”);
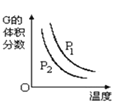
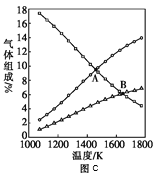
③图c是表示反应2H2S(g)=2H2(g)+S2(g)平衡时,装置内各组分气体物质的量分数=与温度的关系(其中Ar气体变化曲线未画出)。请计算:C点的平衡常数K=______;D点平衡时,H2S的转化率=______。