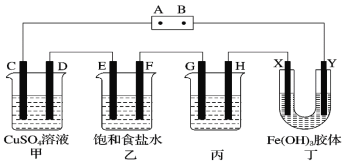
【题目】Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥_____mol/L。
③反应Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)___________。
【题目】碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,![]() ______ 。
______ 。

(2)在体积为2L的密闭容器中,充入1mol ![]() 和3mol H,一定条件下发生反应:
和3mol H,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的物质的量随时间变化的曲线如图所示:
的物质的量随时间变化的曲线如图所示:
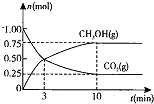
①从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]() ______ 。
______ 。
②下列措施中能使化学平衡向正反应方向移动的是 ______ ![]() 填编号
填编号![]() 。
。
A.升高温度
![]() 将
将![]() 及时液化移出
及时液化移出
C.选择高效催化剂
![]() 再充入1mol
再充入1mol ![]() 和4mol
和4mol ![]()
(3)![]() 溶于水生成碳酸。已知下列数据:
溶于水生成碳酸。已知下列数据:
弱电解质 |
|
|
电离平衡常数 |
|
|
现有常温下![]() 的
的![]() 溶液,已知:
溶液,已知:![]() 水解的平衡常数
水解的平衡常数![]() ,
,![]() 第一步水解的平衡常数
第一步水解的平衡常数![]() 。
。
①判断该溶液呈 ______ ![]() 填“酸”、“中”、“碱”
填“酸”、“中”、“碱”![]() 性,写出该溶液中
性,写出该溶液中![]() 发生第一步水解的离子方程式 ______ 。
发生第一步水解的离子方程式 ______ 。
②下列粒子之间的关系式,其中正确的是 ______ 。
A.![]()
B.![]()
C.![]()
D.![]()
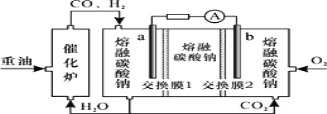
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和![]() 为原料做成电池。原理如图所示:
为原料做成电池。原理如图所示:
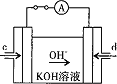
通入CO的管口是 ______ ![]() 填“c”或“d”
填“c”或“d”![]() ,写出该电极的电极反应式: ______ 。
,写出该电极的电极反应式: ______ 。
【题目】某工厂对制革工业污泥中铬的处理工艺流程如下:
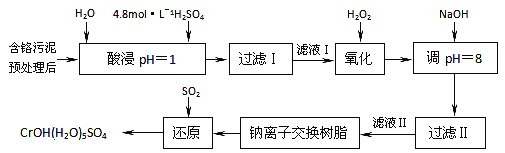
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________________________。
②常温下,当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1mol·L-1)___________ 。 (填“是”或“否”)若要使Mg2+完全沉淀,溶液的pH至少为_________(已知Ksp[Mg(OH)2]=1. 6×10-12,lg2=0.3)。