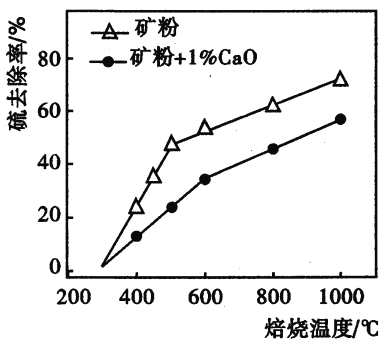
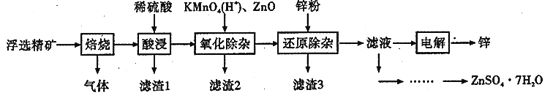
【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:
①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。
【题目】碳和氮的化合物在生产、生活中广泛存在。请回答下列问题:
(1)资料显示,可用次氯酸钠处理废水中的氨氮![]() ,使其转化为氮气除去。其主要反应如下
,使其转化为氮气除去。其主要反应如下
I.![]()
![]()
![]()
![]()
①以上反应中HClO的来源用化学用语解释是______。
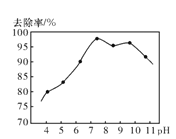
②实验测得。废水中pH与氨氮去除率的关系如图所示。pH较高时,氨氮去除率下降的原因是___。
(2)甲酶是重要的化工原料,又可作为燃料,工业上可利用CO或![]() 来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | ||
|
|
|
|
|
|
|
|
|
|
|
| |||
①下列措施能使反应![]() 的平衡体系中
的平衡体系中![]() 增大的是______
增大的是______![]() 填字母代号
填字母代号![]() 。
。
A.将![]() 从体系中分离出去
从体系中分离出去![]() 充入
充入![]() ,使体系压强增大
,使体系压强增大
C.升高温度![]() 恒容时再充入1mol
恒容时再充入1mol![]()
![]()
②500℃时测得反应![]() 在某时刻
在某时刻![]() 、
、![]() 、
、![]() 、
、![]() 的浓度分別为
的浓度分別为![]() 、
、![]() 、
、![]() 、
、![]() ,则此时正
,则此时正![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() v
v![]() 逆
逆![]() 。
。
(3)常温下,在![]() 溶液中,反应
溶液中,反应![]() 的化学平衡常数
的化学平衡常数![]() ______。
______。![]() 已知:常温下,
已知:常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离衡常数
的电离衡常数![]() 、
、![]()
(4)电解硝酸上业的尾气NO可制备![]() ,其工作原理如图所示:
,其工作原理如图所示:
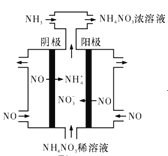
①阴极的电极反应式为______。
②将电解生成的![]() 全部转化为
全部转化为![]() ,则通入的
,则通入的![]() 与实际参加反应的NO的物质的量之比至少为___。
与实际参加反应的NO的物质的量之比至少为___。
【题目】常温下,浓度均为0.1 molL-1的4种钠盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中不正确的是
A. 四种溶液中,Na2CO3溶液中水的电离程度最大
B. 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度
C. NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32-
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3