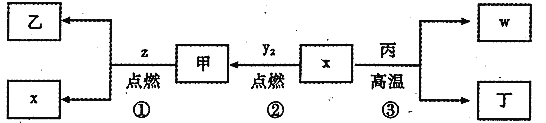
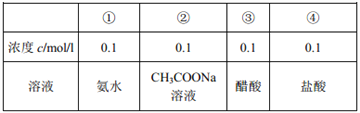
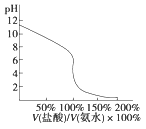
题目内容
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl △H=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
Si(s)+4HCl △H=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L·min)
D.反应吸收0.025QkJ热量时,生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应
【答案】D
【解析】
A. 反应过程中,因为反应物气体分子数小于生成物气体分子数,所以若增大压强,平衡逆向移动,SiCl4的转化率降低,A错误;
B. 若反应开始时SiCl4为1mol,则参加反应的SiCl4<1mol,达平衡时,吸收热量<QkJ,B错误;
C. 反应至4min时,若HCl浓度为0.12mol/L,则参加反应的H2的物质的量浓度为0.06mol/L,H2表示的反应速率为0.015mol/(L·min),C错误;
D. 反应吸收0.025QkJ热量时,生成的HCl为0.025×4=0.1mol,通入100mL1mol/L的NaOH溶液中恰好完全反应,D正确。
故选D。

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快