【题目】某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。 学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取mg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;发生反应:IO3﹣+5I﹣+6H+=3I2+3H2O,将反应后的溶液加水稀释至100.00 mL。
c.取10.00mL上述溶液到锥形瓶中,以淀粉为指示剂,用物质的量浓度为3.0molL﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣)。
d.重复实验2次,三次实验分别记录有关数据如下:
滴定次数 | 待测溶液的体积/mL | 1.00×10﹣3molL﹣1的 Na2S2O3溶液的体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 10.00 | 2.62 | 22.60 |
第二次 | 10.00 | 7.56 | 30.30 |
第三次 | 10.00 | 6.22 | 26.24 |
试回答:
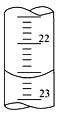
(1)如下图,是某次滴定时的滴定管中的液面,其读数为___________mL。
(2)判断到达滴定终点的现象是:_______________________。
(3)滴定时,Na2S2O3溶液应放在______________ (填“酸式滴定管”或“碱式滴定管”)。
(4)根据实验测定数据,计算加碘食盐样品中的碘元素百分含量是_______(以含m的代数式表示)。
(5)根据上述实验对下列假定情况进行讨论,导致测出待测液的浓度是(填“偏小”、“偏大”或“无影响”)
①标准液读数时,若滴定前俯视,滴定后仰视,测出待测液的浓度__________
②盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,测出待测液的浓度___
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJ/mol
CO(g)+3H2(g) △H1=+206.1kJ/mol
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H2=+247.3kJ/mol
2CO(g)+2H2(g) △H2=+247.3kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ/mol
CO2(g)+H2(g) △H3=-41.2kJ/mol
请回答下列问题:
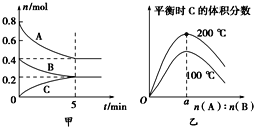
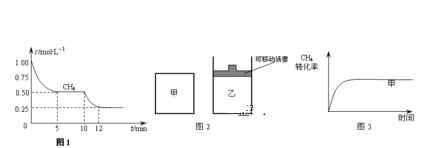
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v (H2)=_____;10min时,改变的外界条件可能是________。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象_____。
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是____________(填代号)。
a.v(正)>v (逆) b.v(正)<v (逆)
c.v(正)= v (逆) d.无法判断.
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)以上三种电解质的酸性由强至弱顺序为__________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为______,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者________后者(填“>、<或=”)。
(3)已知NaHSO3溶液显酸性,其原因是____________(离子方程式配适当文字叙述)。
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质 | X | Y | Z |
初始浓度/ | 0.1 | 0.2 | 0 |
平衡浓度/ | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
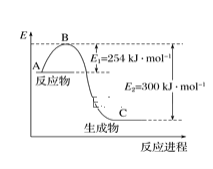
(1)下图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:___________________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
②N2(g)+O2(g)═2NO(g) ΔH2=-bkJ·mol-1
若1molNH3还原NO至N2,则该反应过程中的热化学方程式:________。(用含a、b的式子表示ΔH3)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应 Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应 Ⅱ:NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________________。