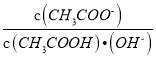题目内容
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4,⑨NH3H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为_____________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH﹣)=_________;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=___________。
(3)已知水存在如下平衡:H2O+H2O![]() H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_________。
H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_________。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃[其中c(H+)=1×10﹣6mol/L] D.向水中加入NH4Cl固体
(4)在常温下,NH3H2O的电离常数为1.810-5,若浓度均为0.1mol/L、等体积的NaOH和NH3H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 m_________n(填“<”、“>”或“=”)。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_____。
【答案】c(Cl-)>c(NH4+)>c(H+)> c(OH- ) 10-3mol/L 10-11mol/L D > ⑧⑥⑦⑨
【解析】
(1)、NH4Cl为强酸弱碱盐,NH4+水解导致溶液呈酸性,根据电荷守恒判断离子浓度大小;
(2)、CH3COONa溶液中,醋酸根水解,促进水的电离,所以溶液中水电离出的氢氧根离子就是溶液中的氢氧根离子,CH3COOH溶液中,水电离受到抑制,水电离出来的氢离子等于溶液中的氢氧根离子,据此计算;
(3)、使水的电离平衡向右移动的方法有:升高温度、加入含有弱根离子的盐等,如果溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性;
(4)、一水合氨为弱电解质,不能完全电离,加水,会促进弱电解质的电离,若稀释后溶液pH相等,则氢氧化钠稀释体积小于一水合氨;
(5)、根据影响盐类水解因素比较浓度相同的溶液的NH4+浓度大小。
(1)、NH4Cl为强酸弱碱盐,NH4+水解导致溶液呈酸性,即c(OH-)< c(H+),根据电荷守恒得c(Cl-)> c(NH4+),所以离子浓度大小顺序是c(Cl-)>c(NH4+)> c(H+)> c(OH- );故答案为c(Cl-)>c(NH4+)> c(H+)> c(OH- );
(2)、pH= 11的CH3COONa溶液中,醋酸根水解,促进水的电离,所以溶液中水电离出的氢氧根离子就是溶液中的氢氧根离子,水电离出来的c(OH- )=![]() ;在pH=3的CH3COOH溶液中,水电离受到抑制,水电离出来的氢离子等于溶液中的氢氧根离子,水电离出来的c(H+ )=
;在pH=3的CH3COOH溶液中,水电离受到抑制,水电离出来的氢离子等于溶液中的氢氧根离子,水电离出来的c(H+ )=![]() ;故答案为10-3mol/L;10-11mol/L;
;故答案为10-3mol/L;10-11mol/L;
(3)A、向水中加入NaHSO4,NaHSO4电离出氢离子,抑制水电离,平衡逆向移动,导致溶液中c(H+)> c(OH-),溶液呈酸性,A不符合;
B、向水中加入碳酸氢钠,能水解,碳酸氢根离子可以和氢离子结合,从而促进水电离,导致溶液中c(OH- ) > c(H+),溶液呈碱性,B不符合;
C、水的电离是吸热反应,加热至100℃,促进水电离,溶液c(OH-)= c(H+),溶液呈中性,C不符合;
D、向水中加入(NH4)2SO4,(NH4)2SO4是强酸弱碱盐能水解,铵根离子与氢氧根离子结合生成一水合氨,从而促进水电离,导致溶液中c(OH-)< c(H+),溶液呈酸性,D符合;故选D;
(4)、氨水为弱电解质,不能完全电离,若浓度均为0.1mol/L、等体积的NaOH和NH3H2O分别加水稀释n倍、m倍,稀释后两种溶液的pH都变成9,即溶液中氢氧根离子浓度均为110-5mol/L,则氢氧化钠溶液稀释的倍数为m=10000倍;由K= ,则c(NH3H2O)=5.610-6mol/L,c(NH3. H2O)总=5.610-6mol/L+110-5mol/L=1.5610-5mol/L,故氨水稀释的倍数为n=
,则c(NH3H2O)=5.610-6mol/L,c(NH3. H2O)总=5.610-6mol/L+110-5mol/L=1.5610-5mol/L,故氨水稀释的倍数为n=![]() ,因此,m>n;故答案为> ;
,因此,m>n;故答案为> ;
(5)、⑥NH4Cl中只存在NH4+水解,且水解是微弱的;⑦CH3COONH4中CH3COO-和NH4+相互促进水解,NH4+浓度小于⑥;⑧NH4HSO4中H+抑制NH4+水解,NH4+浓度大于⑥;⑨NH3H2O中只存在NH3H2O电离,且电离是微弱的,故NH4+浓度大到小的顺序是⑧⑥⑦⑨;故答案为⑧⑥⑦⑨。

 名校课堂系列答案
名校课堂系列答案【题目】(1)严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 |
15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是____(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
(2)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
①若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”)。
②下列不能说明该反应已达到平衡状态的是________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
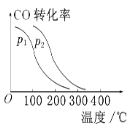
③在一定压强下,容积为V L的容器充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1________p2(填“大于”“小于”或“等于”,下同),ΔH________0。