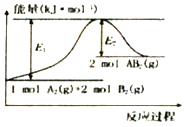
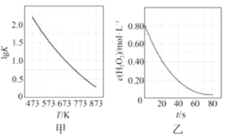
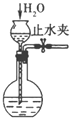
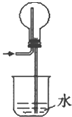
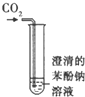
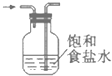
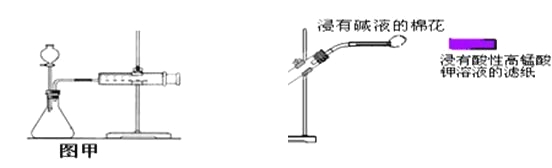
0 201858 201866 201872 201876 201882 201884 201888 201894 201896 201902 201908 201912 201914 201918 201924 201926 201932 201936 201938 201942 201944 201948 201950 201952 201953 201954 201956 201957 201958 201960 201962 201966 201968 201972 201974 201978 201984 201986 201992 201996 201998 202002 202008 202014 202016 202022 202026 202028 202034 202038 202044 202052 203614