��Ŀ����
����Ŀ����֪ij��ѧ��ӦA2(g)+2B2(g)=2AB2(g) ��A2��B2��AB2�Ľṹʽ�ֱ�ΪA=A��B-B��B-A-B���������仯��ͼ��ʾ�������й���������ȷ����
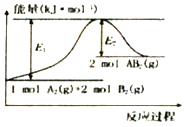
A. �÷�Ӧ������2molAB2(g)�����յ�����Ϊ��El-E2��kJ
B. �÷�Ӧ�Ľ���һ����Ҫ���Ȼ��ȼ����
C. �÷�Ӧ�Ͽ���ѧ�����ĵ�������С���γɻ�ѧ���ͷŵ�������
D. ����2molB-B���ų�E2kJ����
���𰸡�A
��������A���÷�Ӧ�ʱ�=���ѻ�ѧ����������-�γɻ�ѧ�����ų������������ʱ�Ϊ��H=+(E1-E2)kJ/mol����ͼʾ��֪E1��E2���ʱ�Ϊ��H��0���ȣ��÷�Ӧ������2molAB2(g)�����յ�����Ϊ (E1-E2) kJ����A��ȷ��B����Ӧǰ�������غ��֪����Ӧ������֮��С�������������֮�ͣ���Ӧ�����ȷ�Ӧ�����ȷ�Ӧ��һ����Ҫ���Ȼ��ȼ���������������������Ȼ���ڳ����¾ͷ�Ӧ����B����C����Ӧ�����ȷ�Ӧ�����������غ��֪������Ӧ��ļ����ܺʹ���������ļ����ܺͣ��Ͽ���ѧ�����ĵ������������γɻ�ѧ���ͷŵ�����������C����D������ͼ������ж�1molA2��2molB2��Ӧ����2molAB2������(E1-E2)kJ�������������2molB-B���ų�(E1-E2)kJ��������D����ѡA��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ͼΪŨ������ͭƬ��Ӧ��װ�á�

��ش�
��1��Ũ������ͭƬ��Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧһ��ʱ����Թ�����Ʒ����Һ�������� ��
��3�������йظ�ʵ���˵���У�����ȷ���� ��
A���÷�Ӧ��Ũ����ֻ�������� |
B���Թ����к��м�Һ�����������������չ�����SO2����ֹ������Ⱦ |
C����Ӧһ��ʱ����Թܼ��е���Һ��������ʢ��ˮ���ձ�����Һ����ɫ |
D����0.04mol���ʵ�Ũ������������ͭƬ��Ӧ�����ռ���448mL��SO2(��״��) |