题目内容
【题目】下列说法正确的是
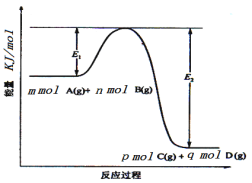
A.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目等于6×6.02×1023
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应
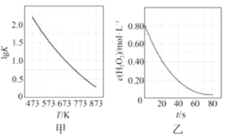
C.图甲是CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
D.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐增大
【答案】C
【解析】
A.合成氨反应可逆, 3 mol H2与1 mol N2混合反应生成NH3,参加反应的氮气小于1mol,转移电子的数目小于6×6.02×1023,故A错误;
B. 反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,由于△S<0,所以△H<0,该反应为放热反应,故B错误;
C. 根据图甲,升高温度,平衡常数减小,所以CO(g)+H2O(g)=CO2(g)+H2(g)正反应放热,ΔH<0,故C正确;
D.根据室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小,故D错误;
答案选C。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目