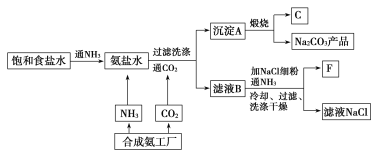
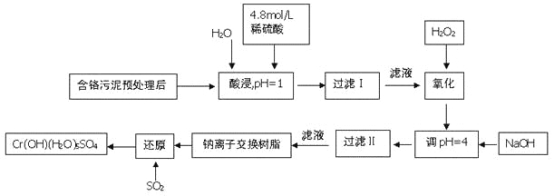
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测。某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+, Fe2+, Al3+, Ca2+, Mg2+)
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是_____________________________(至少一条)
(2)调pH=4.0是为了除去______________________(填Fe3+, Al3+, Ca2+, Mg2+)
(3)钠离子交换树脂的原理为Mn++ n NaR → MRn+nNa+,被交换的杂质离子是___________________________(填Fe3+, Al3+, Ca2+, Mg2+)
(4)试配平下列氧化还原反应方程式:
____Na2Cr2O7+__SO2+____H2O =____Cr(OH)(H2O)5SO4+___Na2SO4
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
【题目】下列实验能达到实验目的的是______ 。
序号 | 实验内容 | 实验目的 |
A | 盛有 | 探究浓度对反应速率的影响 |
B | 用石墨电极电解 | 比较确定铜和镁的金属活动性强弱 |
C | 在容积可变的密闭容器中发生反应:2NO2(g) | 正反应速率加快,逆反应速率减慢 |
D | 向2支试管中各加入相同体积、相同浓度的 | 探究温度对反应速率的影响 |
A.AB.BC.CD.D