题目内容
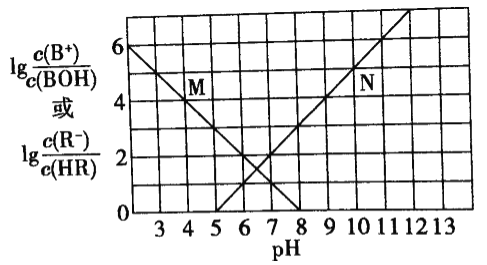
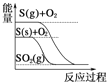
【题目】已知某可逆反应:mA(g)+nB(g)![]() xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )

A.T1>T2,P1>P2,m+n>x,Q>0B.T1<T2,P1<P2,m+n<x,Q>0
C.T1>T2,P1<P2,m+n<x,Q<0D.T1<T2,P1<P2,m+n>x,Q<0
【答案】C
【解析】
温度相同时,根据到达平衡的时间判断压强大小,再根据压强对C的含量的影响,判断压强对平衡的影响,确定反应气体气体体积变化情况;
压强相同时,根据到达平衡的时间判断温度大小,再根据温度对C的含量的影响,判断温度对平衡的影响,确定反应的热效应。
由图象可知,温度为T1时,压强为P2时先达到平衡,根据平衡移动原理:增大压强,反应速率加快,达到平衡所需要的时间缩短,所以压强:P2>P1,且压强越大,C的含量越低,说明增大压强,化学平衡向逆反应方向移动,根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动,故正反应为气体体积增大的反应,即m+n<x;
在压强为P2时,根据图象可知温度为T1时先达到平衡,由于温度越高,速率越快,达到平衡所需要的时间越短,可知温度T1>T2;温度升高,C的含量越低,说明升高温度,化学平衡向逆反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,则该反应的正反应为放热反应,即Q<0,
故合理选项是C。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目