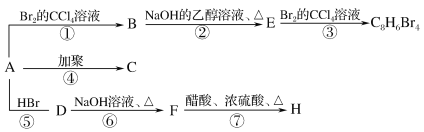
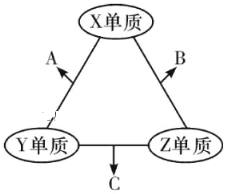
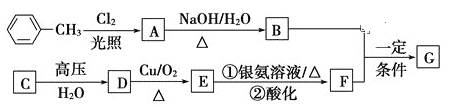
题目内容
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
【答案】B
【解析】
A. II可以看成是向2L的容器中,充入0.4mol的X和0.2mol的Y(则I、II的平衡等效),平衡后再将容器压缩至1L,由于压强增大,平衡向右移动,所以II中X的转化率>I,A正确;
B. 平衡常数只和温度有关,I、II的温度相同,则这两个平衡的平衡常数也相同,B错误;
C. III的温度比I高,III的化学反应速率也快,则III先达到平衡,C正确;
D. 对比I和III,二者起始状态,除了温度不同,其他条件都相同,则可以将III看作是I达到平衡后,升高温度,Z的浓度降低了,说明升温使得平衡向逆反应方向移动,则正反应为放热反应,即反应的ΔH<0,D正确;
故合理选项为B。

【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) ![]() N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A.反应在0~3s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH<0
C.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
D.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%