【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为Cu、
外,还含有少量稀贵金属,主要物质为Cu、![]() 和
和![]() 。某铜沉淀渣的主要元素质量分数如下:
。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数 |
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
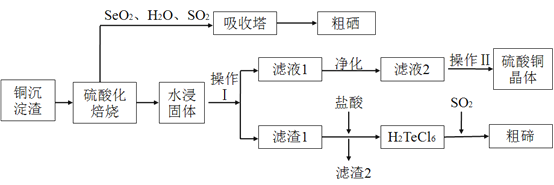
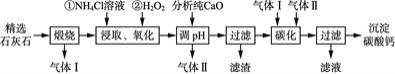
![]() 经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:
经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:![]() ____
____![]()
![]()
![]() ____
____![]() ____
____![]() ____
____![]()
![]() 与吸收塔中的
与吸收塔中的![]() 反应生成亚硒酸。焙烧产生的
反应生成亚硒酸。焙烧产生的![]() 气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
![]() 沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
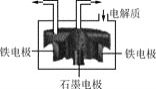
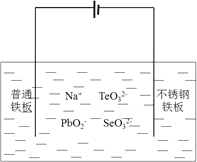
![]() 目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着
目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
【题目】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如图1:
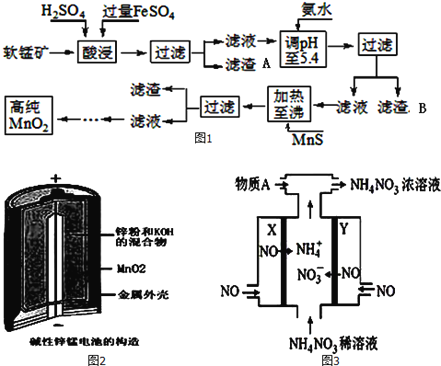
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________;
(2)滤渣A的主要成分是____________;滤渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+杂质,可能原因是_________________;
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为________________,电池总反应的方程式为_______________________;
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极__________极,电解时阳极的电极反应为________________,使电解产物全部转化为NH4NO3,需补充物质A,A是__________;