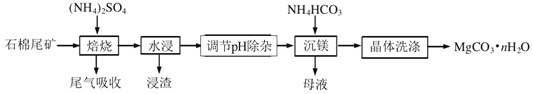
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:

已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
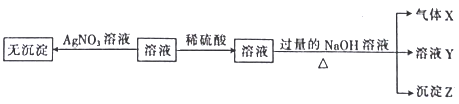
【题目】某强酸性无色溶液中可能含下表中的若干种离子。
阳离子 | Mg2+、NH |
阴离子 | SiO |
实验I:取少量该溶液进行如图实验。
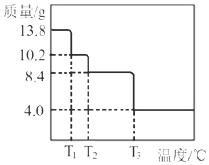
实验II:为了进一步确定该溶液的组成,取200mL原溶液,向该溶液中滴加2molL-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
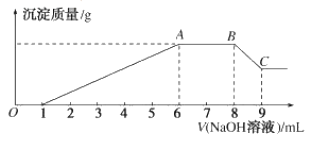
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是___。
(3)写出实验II的图像中BC段对应的离子方程式:___。
(4)A点对应的固体质量为___ g。
(5)该溶液中阴离子的浓度为___ molL-1。