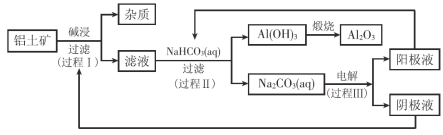
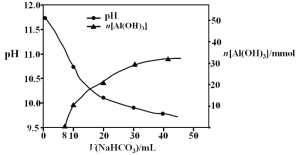
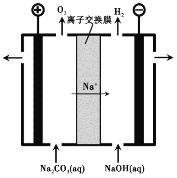
【题目】元素周期律(表)是认识元素化合物性质的重要理论。
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈
ⅱ.锂和镁的氢氧化物均为中等强度的碱
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物
根据以上事实,可知锂、钠、镁三种元素的金属性强弱关系是___________________(用“>”“=”或“<”)。
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
①碱性:Sr(OH)2_____ Ba (OH)2(填“>”或“<”)。
②用原子结构的观点解释锶的化学性质与钡差异的原因:______________________________
(3)硒(Se)的部分信息如图,且知34Se、35Br位于同一周期。
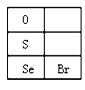
①Se在元素周期表中的位置是_______________。
②H2Se的电子式是______________。
③Cl、Se、Br的非金属性强弱的顺序是__________________;能证明上述强弱关系的事实是____________________________(写出一条即可)。
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的。完成下表:
编号 | 性质推测 | 化学方程式 |
1 | 氧化性 | SeO2+2SO2+2H2O=Se+2H2SO4 |
2 | ____________ | ______________ |
3 | ___________ | ____________ |
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是___。
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中![]() 不变 D.溶液中
不变 D.溶液中![]() 减小
减小
(2)常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=___(溶液体积变化忽略不计)。
(3)常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是___。
(4)常温下,在pH=9的CH3COONa溶液中,由水电离出的OH-浓度___。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__;
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) __。