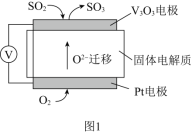
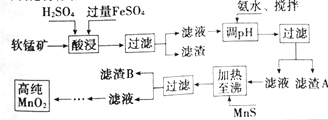
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%),Fe(5.86%),Al(3.42%),Zn(2.68%)和Cu(0.86%)等元素的氧化物,其处理流程图如下:
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
KSP近似值 | 10-34 | 10-16 | 10-38 |
(1)灼烧软锰矿样品时,铜的焰色为___(填字母)。
A.黄色 B.绿色 C.紫色 D.红色
(2)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子反应方程式为___。
(3)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___。滤渣S的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5mol·L-1时,认为该离子沉淀完全)。
(4)滤渣B的成分是___。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中10.00mL,恰好与25.00mL0.0800 mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算该样品纯度为___%(精确到0.1%)。
(6)从废旧碱性锌锰电池中可以回收利用的物质有___(写两种)。
【题目】可燃冰(天然气水合物,可用CH4xH2O表示)的开采和利用,既有助于解决人类面临的能源危机,又能生产一系列的工业产品。
(1)可燃冰在一定条件下能够释放出CH4气体,该条件是________(填“低温、高压”或“高温、低压”)。
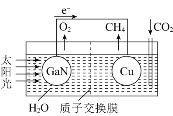
(2)熔融碳酸盐型燃料电池(MCFC)通常被称为第二代燃料电池。以CH4为MCFC的燃料时,电池的工作原理如图所示。
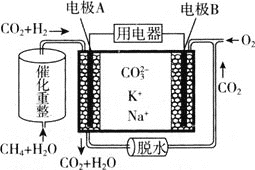
①CH4(g)和H2O(g)可在电池内部经重整反应转化为H2(g)和CO2(g),已知CH4和H2的标准燃烧热分别为890.3kJ/mol和285.8kJ/mol,H2O(l)=H2O(g) H=+41 kJ/mol,则甲烷重整反应的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g) H=________kJ/mol。
②图中电极A为燃料电池的________(填“正极”或“负极”),电极B上的电极反应式为________。
(3)在压强为p的恒压容器中,CH4在电弧炉的作用下制取乙炔,化学方程式为2CH4=C2H2+3H2。下表为反应体系的物料衡算表。
成分 | 进料 | 出料 | ||
纯CH4 | CH4 | C2H2 | H2 | |
物质的量(mol) | 44.8 | 19.13 | 8.96 | 39.5 |
①计算可知C2H2的产率α=________。
②出料中C2H2和H2的物质的量之比并不等于1:3,可能的原因是________。
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
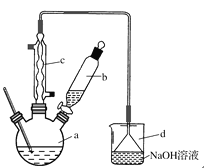
按下列合成步骤回答问题:
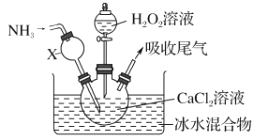
(1)在a中加入15 mL无水苯和少量铁屑。由b向a中加入4 mL液溴。烧瓶a中发生反应的化学方程式是______。装置d的作用是_________________;装置c的作用是__________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质的名称是________,进一步提纯操作方法是________。
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL C.250 mL D.500 mL