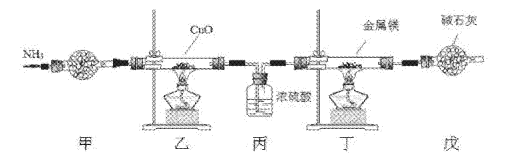
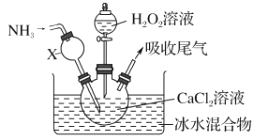
题目内容
【题目】(1)基态O原子核外电子排布式为_______,基态P原子核外占据最高能级的电子云轮廓图为_________形;
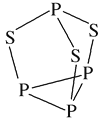
(2)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为___________,每个P4S3分子中含孤电子对的数目为_______。
(3)Na、O、S简单离子半径由大到小的顺序为__________
(4)SO2易溶于水,在水中的溶解度为1体积的水溶解40体积的SO2,原因是________。
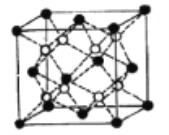
(5)Li2O的晶胞如图所示(其中白球代表Li,黑球代表O)。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式即可)。
【答案】1s22s22p4 哑铃 sp3 10 S2->O2->Na+ SO2是极性分子,水是极性分子构成的溶剂,根据相似相容原理,SO2易溶于水 ![]()
【解析】
(1)O原子核外有8个电子,根据构造原理书写基态O原子核外电子排布式;p能级电子的电子云轮廓图为哑铃形;
(2)根据图像,P、S最外层均满足8电子稳定结构,S形成2个共键单键,且S上有2个孤电子对,P上有1个孤电子对;
(3)一般而言,离子核外电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(4)根据相似相容原理分析解答;
(5)根据均摊法计算晶胞中Li+和O2-个数,求出晶胞质量和体积,最后计算Li2O的密度。
(1)O原子核外有8个电子,根据构造原理,基态O原子核外电子排布式为1s22s22p4;基态P原子核外占据最高能级的电子为3p能级电子,s能级电子的电子云轮廓图为球形,p能级电子的电子云轮廓图为哑铃形,则基态P原子核外占据最高能级的电子云轮廓图为哑铃形,故答案为:1s22s22p4;哑铃;
(2)根据分子结构示意图,S原子形成2个共键单键,且S上有2个孤电子对,则P4S3分子中硫原子的杂化轨道类型为sp3;每个S原子上有2个孤电子对,P原子上有1个孤电子对,则每个P4S3分子中含孤电子对的数目为10,故答案为:sp3;10;
(3)一般而言,离子核外电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,离子核外电子层数S2-最多,离子半径最大,O2-、Na+核外电子层数相同,且原子序数O<Na,则离子半径从大到小顺序是S2->O2->Na+,故答案为:S2->O2->Na+;
(4)SO2中S原子形成2个共价键,且S上有1个孤电子对,采用sp2杂化,为V形结构,是极性分子,水是极性分子构成的溶剂,根据相似相容原理,SO2易溶于水,在水中的溶解度为1体积的水溶解40体积的SO2,故答案为:SO2是极性分子,水是极性分子构成的溶剂,根据相似相容原理,SO2易溶于水;
(5)该晶胞中Li+个数=8、O2-个数=8×![]() +6×
+6×![]() =4,晶胞质量=
=4,晶胞质量=![]() g,晶胞体积=(0.4665×10-7cm)3,则Li2O的密度=
g,晶胞体积=(0.4665×10-7cm)3,则Li2O的密度=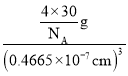 =
= ![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】现有短周期元素性质的部分数据如下表,其中x的值表示不同元素的原子吸引电子的能力大小,若x值越大,元素的非金属性越强,金属性越弱。x值相对较大的元素在所形成的分子中化合价为负。⑩原子的核外电子层数与核外电子总数相同。
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
x | 3.44 | 2.55 | 0.98 | 3.16 | 2.19 | 3.98 | 0.93 | 3.04 | 1.91 | |
常见化合价 | 最高价 | +4 | +1 | +1 | +4 | |||||
最低价 | -2 | -1 | -3 | -1 | -3 | |||||
(1)根据以上条件,推断③④⑤的元素符号分别为:___,__,__。
(2)②的最高价氧化物的固体属于__晶体,空间构型__。
(3)用电子式表示下列原子相互结合成的化合物电子式:
①+⑦+⑩:___,
①+⑩形成原子个数比为1:1的化合物:__。
(4)写出①与⑦所形成仅含离子键的化合物和④与⑩所形成的化合物反应的离子方程式:___。