题目内容
【题目】可燃冰(天然气水合物,可用CH4xH2O表示)的开采和利用,既有助于解决人类面临的能源危机,又能生产一系列的工业产品。
(1)可燃冰在一定条件下能够释放出CH4气体,该条件是________(填“低温、高压”或“高温、低压”)。
(2)熔融碳酸盐型燃料电池(MCFC)通常被称为第二代燃料电池。以CH4为MCFC的燃料时,电池的工作原理如图所示。
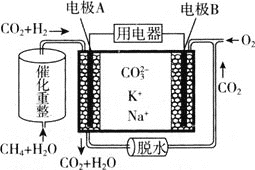
①CH4(g)和H2O(g)可在电池内部经重整反应转化为H2(g)和CO2(g),已知CH4和H2的标准燃烧热分别为890.3kJ/mol和285.8kJ/mol,H2O(l)=H2O(g) H=+41 kJ/mol,则甲烷重整反应的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g) H=________kJ/mol。
②图中电极A为燃料电池的________(填“正极”或“负极”),电极B上的电极反应式为________。
(3)在压强为p的恒压容器中,CH4在电弧炉的作用下制取乙炔,化学方程式为2CH4=C2H2+3H2。下表为反应体系的物料衡算表。
成分 | 进料 | 出料 | ||
纯CH4 | CH4 | C2H2 | H2 | |
物质的量(mol) | 44.8 | 19.13 | 8.96 | 39.5 |
①计算可知C2H2的产率α=________。
②出料中C2H2和H2的物质的量之比并不等于1:3,可能的原因是________。
【答案】高温、低压 +170.9kJ/mol 负极 O2+4e-+2CO2=CO32- 40% 该反应存在较多副反应(或甲烷、乙炔分解或乙炔与氢气发生加成反应等)
【解析】
(1)![]() 高温、低压条件有利于CH4的逸出;
高温、低压条件有利于CH4的逸出;
(2)①根据盖斯定律计算;
②燃料电池中,通入燃气的一极是负极,通入空气的一极是正极,电解质是熔融碳酸盐;
(3)①产率=![]() ×100%;
×100%;
②有产生氢气的副反应存在导致出料中C2H2和H2的物质的量之比不等于1:3。
(1)![]() 可燃冰释放出CH4的过程中是产生气体的过程,高温、低压条件有利于CH4的逸出;
可燃冰释放出CH4的过程中是产生气体的过程,高温、低压条件有利于CH4的逸出;
(2)①由题意可知:①CH4(g)+2O2(g)=CO2(g)+H2O(l) H1=-890.3kJ/mol;②H2(g)+![]() O2(g)= H2O(l) H2=-285.8kJ/mol;③H2O(l)=H2O(g) H3=+41kJ/mol;根据盖斯定律,①-4②-2③可得CH4(g)+2H2O(g)=4H2(g)+CO2(g) H=-890.3+285.8×4-41×2=+170.9kJ/mol;
O2(g)= H2O(l) H2=-285.8kJ/mol;③H2O(l)=H2O(g) H3=+41kJ/mol;根据盖斯定律,①-4②-2③可得CH4(g)+2H2O(g)=4H2(g)+CO2(g) H=-890.3+285.8×4-41×2=+170.9kJ/mol;
②燃料电池中,通入燃气的一极是负极,通入空气的一极是正极,电解质是熔融碳酸盐,则正极的电极反应式为O2+4e-+2CO2=CO32-;
(3)①题中所给数据,理论产量为22.4mol,实际生成C2H2为8.96mol,则产率=![]() =40%;
=40%;
②出料中C2H2和H2的物质的量之比并不等于1:3,可能的原因是该反应存在较多副反应(或甲烷、乙炔分解或乙炔与氢气发生加成反应等)。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案