题目内容
【题目】电化学原理在生产生活中应用十分广泛。请回答下列问题:
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示。
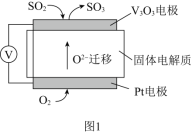
①固体电解质中O2-向______极移动(填“正”或“负”)。
②写出V2O5电极的电极反应式:_____________。
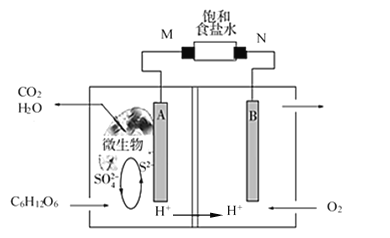
(2)近期科学家研究发现微生物可将生产废水中的尿素[CO(NH2)2]直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:
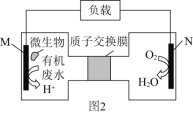
①N极为____极(填“正”或“负”),M电极反应式______________________。
②N极消耗标准状况下33.6L气体时,M极理论上处理的尿素的质量为______g。
(3)人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是__________。
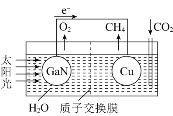
A.该装置为原电池,且铜为正极
B.电池工作时,H+向Cu电极移动
C.GaN电极表面的电极反应式为2H2O-4e-=O2+4H+
D.反应CO2+2H2O![]() CH4+2O2中每消耗1molCO2转移4mole-
CH4+2O2中每消耗1molCO2转移4mole-
【答案】负 SO2-2e-+O2-=SO3 正 CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+ 60 D
【解析】
(1)根据图像,原电池内电路,阴离子向负极移动;
(2)N电极氧气变为水,化合价降低,得电子为正极;
(3)该装置无外加电源,为原电池,铜极上C的化合价降低,得电子,为正极。
(1)根据图像,原电池内电路,阴离子向负极移动,固体电解质中O2-向负极移动,Pt电极为正极:O2+4e-=2O2-,则V2O5电极为负极:SO2-2e-+O2-=SO3;
(2)N电极氧气变为水,化合价降低,得电子为正极,反应式为O2↑+4H++4e-=2H2O,M为负极:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+;N极消耗标准状况下33.6L气体时,即消耗1.5mol的O2,得处理![]() =1mol的尿素,即60g的尿素;
=1mol的尿素,即60g的尿素;
(3)A.该装置无外加电源,为原电池,铜极上C的化合价降低,得电子,为正极,与题意不符,A不选;
B.电池工作时,H+为阳离子,向正极移动,即向Cu电极移动,与题意不符,B不选;
C.GaN电极为负极,失电子,表面的电极反应式为2H2O-4e-=O2↑+4H+,与题意不符,C不选;
D.反应CO2+2H2O![]() CH4+2O2中每消耗1molCO2化合价由+4变为-4,转移8mole-,符合题意,D选;
CH4+2O2中每消耗1molCO2化合价由+4变为-4,转移8mole-,符合题意,D选;
答案为D。

 高中必刷题系列答案
高中必刷题系列答案【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。