【题目】下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | NO2球浸泡在冰水中 | 颜色变浅 | 生成N2O4的反应是吸热过程 |
C | Na2S2O3溶液与稀硫酸反应,改变反应的温度 | 只有浑浊产生,温度越高,出现浑浊时间越短 | 温度越高,反应速率越快 |
D | 向重铬酸钾稀溶液中滴加3-10滴浓硫酸 | 溶液橙色加深 | 加酸抑制Cr2O72-向CrO42-的转化 |
A.AB.BC.CD.D
【题目】甘氨酸亚铁络合物[(NH2CH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如下:

已知:
甘氨酸(NH2CH2COOH ) | 异抗坏血酸 | 甘氨酸亚铁 | FeSO4.7H2O | FeCl2.4H2O |
易溶入水 | 易溶于水和乙醇 | 易溶于水 | 易溶于水 | 易溶于水 |
微溶于乙醇 | 有弱酸性和强氧化性 | 难溶于乙醇 | 难溶于乙醇 | 易溶于乙醇 |
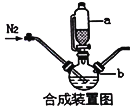
请回答:
(1)合成装置中仪器b的名称是____________
(2)合成过程中,为了防止亚铁被氧化,本实验中采取的措施是____________
(3)下列说法正确的是____________
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ、步骤Ⅳ都有固液分离,可采用常压过滤,也可采用减压过滤
D.粗产品提纯操作为重结晶,过滤,洗涤,干燥,其中干燥过程最好选用真空干燥
(4)合成过程需控制pH=5.5,pH过低或过高都会使产率下降,试说明理由_________________
(5)步骤Ⅲ加入无水乙醇的目的是___________________________________________________
(6)产品纯度可用“凯氏定氮法”测定,测定过程分为以下四步:
I、将有机氮转换为硫酸铵 II、将铵盐转化为氨气蒸出
III、用试剂吸收氨气 IV、滴定
①以下装置可以完成II,III两步操作
②将下列操作按合理顺序排入:
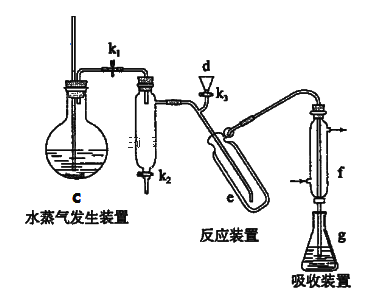
仪器清洗后,在g中加入吸收剂,然后将第I步获得的铵盐试样由d注入e→(_________)→(_________)→(_________)→(_________)→使水蒸气进入e,蒸馏几分钟后,将f下端提离液面并用少量蒸馏水洗涤清洗管口,停止加热c ,移去锥形瓶,立即用标准盐酸溶液进行滴定。
A.打开k1 B.关闭k3、k2 C.加热c D.由d注入氢氧化钠溶液,蒸馏水冲洗,并留少量液体作水封
②关于滴定过程下列说法正确的是____________
A.滴定管必须经检漏、洗涤、润洗后才能使用
B.标准盐酸溶液装入滴定管后,发现下端有气泡,可将橡皮管稍向上弯曲,挤压玻璃珠,气泡可被流水带出
C.滴定刚开始时,左手可以离开旋塞,让溶液自然流下
D.因为本测定方法较为精密和准确而操作过程繁琐,故产品纯度测定一次就可
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
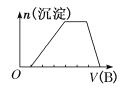
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
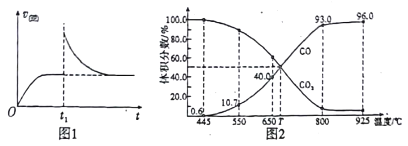
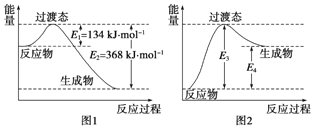
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
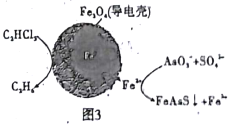
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。