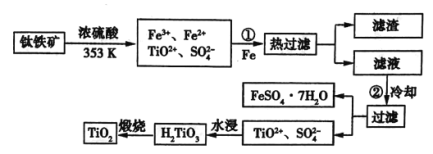
题目内容
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):

(1)写出B的电子式________。
(2)写出由M溶液制B、C、D的化学方程式___________________________________。
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,写出A和B水溶液反应的离子方程式___________________________________。
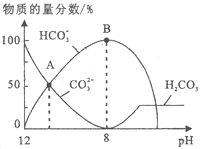
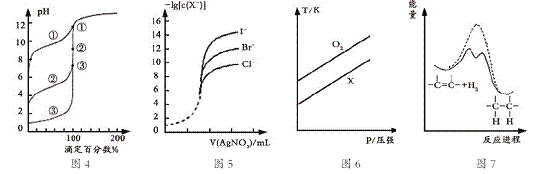
(4)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图所示,则A与B溶液反应后溶液中溶质的化学式为_______。

(5)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________________。
(6)若A是一种氮肥, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为________________。
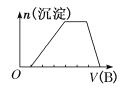
(7)若A是一种溶液,可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32- 、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为______________。
【答案】![]() 2NaCl+2H2O
2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH SiO2+2OH-=SiO32-+H2O NaHCO3、Na2CO3 先有白色沉淀生成,随后沉淀逐渐减少最终消失 3Cl2+8NH3=N2+6NH4Cl c(H+)∶c(Al3+)∶c(NH4+)∶c(SO42-)=1∶1∶2∶3
Cl2↑+H2↑+2NaOH SiO2+2OH-=SiO32-+H2O NaHCO3、Na2CO3 先有白色沉淀生成,随后沉淀逐渐减少最终消失 3Cl2+8NH3=N2+6NH4Cl c(H+)∶c(Al3+)∶c(NH4+)∶c(SO42-)=1∶1∶2∶3
【解析】
(1)M是日常生活中不可缺少的调味品,C可在D中燃烧发出苍白色火焰,应为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH;
(2)根据上述分析,M为NaCl,根据电解食盐水的反应写出相应方式即可;
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,E与F溶液反应可以制备G为H2SiO3;
(4)曲线中,从0.1L~0.3L发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,该阶段消耗盐酸为200mL,而开始产生二氧化碳时消耗盐酸为100mL,小于200mL,所以溶液中的溶质成分NaHCO3、Na2CO3;
(5)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液加入NaAlO2溶液中先生成氢氧化铝沉淀,后又溶解生成铝盐;
(6)若A是一种化肥,A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,则氨气与氯气反应生成氯化铵,同时生成氮气;
(7)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,根据各阶段消耗的NaOH体积结合离子方程式计算n(H+):n(Al3+):n(NH4+)之比,再结合电荷守恒计算与n(SO42-)的比例关系。
(1)M是日常生活中不可缺少的调味品,C可在D中燃烧发出苍白色火焰,应为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,B的电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)电离氯化钠溶液得到氢气、氯气和氢氧化钠,反应方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
(3)A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,E与F溶液反应可以制备G为H2SiO3,A和B水溶液反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO3
(4)假设溶质为碳酸钠,则前后消耗盐酸的体积应相等,而曲线中,从0.1L~0.3L发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,该阶段消耗盐酸为200mL,而开始产生二氧化碳时消耗盐酸为100mL,小于200mL,所以溶液中的溶质成分NaHCO3、Na2CO3,故答案为:NaHCO3、Na2CO3;
(5)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液加入NaAlO2溶液中先生成氢氧化铝沉淀,后又溶解生成铝盐,现象为:先有白色沉淀生成,随后沉淀逐渐减少最终消失,故答案为:先有白色沉淀生成,随后沉淀逐渐减少最终消失;
(6)若A是一种化肥,可用A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,则氨气与氯气反应生成氯化铵,同时生成氮气,E与D反应的化学方程式为:3Cl2+8NH3═N2+6NH4Cl,故答案为:3Cl2+8NH3═N2+6NH4Cl;
(7)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-.发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1体积,发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,发生反应NH4++OH-=NH3H2O,铵根消耗氢氧化钠为2体积,则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知:2n(SO42-)=n(H+)+3n(Al3+)+n(NH4+),故n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3。

【题目】京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
![]() 用
用![]() 催化还原氮氧化物可以消除氮氧化物的污染。已知:
催化还原氮氧化物可以消除氮氧化物的污染。已知:
![]()
![]()
![]()
![]()
![]()
![]()
请写出![]()
![]() 与
与![]()
![]() 反应生成
反应生成![]()
![]() ,
,![]() 和
和![]() 的热化学方程式__________。
的热化学方程式__________。
![]() 用活性炭还原法处理氮氧化物。有关反应为:
用活性炭还原法处理氮氧化物。有关反应为:![]()
![]() ,某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温
,某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温![]() 条件下反应,反应进行到不同时间测得各物质的浓度如下:
条件下反应,反应进行到不同时间测得各物质的浓度如下:
NO |
|
| |
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
40 |
|
|
|
50 |
|
|
|
![]() 下列说法不能作为判断该反应达到化学平衡状态标志的是_______
下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A 活性炭的质量 ![]()
C 容器内压强保持不变 ![]() 容器内混合气体的密度保持不变
容器内混合气体的密度保持不变
E 容器内混合气体的平均相对分子质量保持不变
F 容器内![]() 的浓度保持不变
的浓度保持不变
![]() 在
在![]() 时,该反应的平衡常数为_________
时,该反应的平衡常数为_________![]() 小数点后保留两位有效数字
小数点后保留两位有效数字![]() ;
;
![]() 在
在![]() 时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
![]() 在
在![]() 时保持温度和容器体积不变再充入NO和
时保持温度和容器体积不变再充入NO和![]() ,使二者的浓度均增加至原来的两倍,则化学平衡_______
,使二者的浓度均增加至原来的两倍,则化学平衡_______![]() 填“正向移动”、“逆向移动”或“不移动”
填“正向移动”、“逆向移动”或“不移动”![]()
![]() 利用反应
利用反应![]() 构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
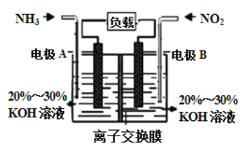
A电极的电极反应式为______________