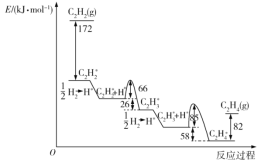
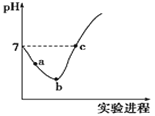
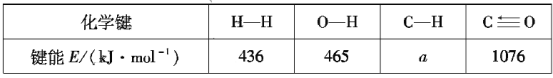
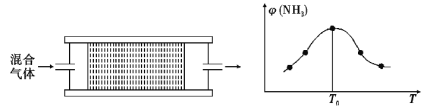
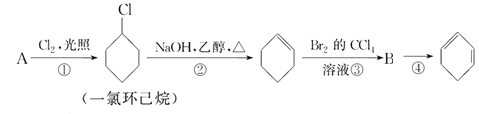
0 200693 200701 200707 200711 200717 200719 200723 200729 200731 200737 200743 200747 200749 200753 200759 200761 200767 200771 200773 200777 200779 200783 200785 200787 200788 200789 200791 200792 200793 200795 200797 200801 200803 200807 200809 200813 200819 200821 200827 200831 200833 200837 200843 200849 200851 200857 200861 200863 200869 200873 200879 200887 203614