题目内容
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
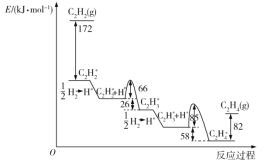
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2

根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。

某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
【答案】415.1 -41.4kJ·mol-1 ![]() AC 温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小 20%
AC 温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小 20% 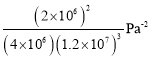
【解析】
(1)根据△H1=反应物键能-生成物键能计算a;根据盖斯定律计算△H2;
(2)根据K=![]() 计算;
计算;
(3)欲增大CH4转化为H2的平衡转化率要使平衡正向移动;
(4)温度低于T0时未达平衡,高于T0时反应达平衡,该反应是放热反应;根据压强比等于气体物质的量之比进行计算;
(1)反应CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1==4a kJ·mol-1+2×465 kJ·mol-1-(1076 kJ·mol-1+3×436 kJ·mol-1)= +206.4kJ·mol-1,解得a=415.1 kJ·mol-1;ⅢCH2(g)+2H2O(g)
CO(g)+3H2(g) △H1==4a kJ·mol-1+2×465 kJ·mol-1-(1076 kJ·mol-1+3×436 kJ·mol-1)= +206.4kJ·mol-1,解得a=415.1 kJ·mol-1;ⅢCH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1,I.CH4(g)+H2O(g)
CO2(g)+4H2(g) △H=+165.0kJ·mol-1,I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1,根据盖斯定律可知II=Ⅲ- I,所以△H2=△H-△H1=+165.0kJ·mol-1-206.4kJ·mol-1=-41.4kJ·mol-1,
CO(g)+3H2(g) △H1=+206.4kJ·mol-1,根据盖斯定律可知II=Ⅲ- I,所以△H2=△H-△H1=+165.0kJ·mol-1-206.4kJ·mol-1=-41.4kJ·mol-1,
故答案为:415.1;-41.4kJ·mol-1;
(2)由n(CO2)=dmol可知反应II生成的n(H2)= dmol,同时消耗的n(CO)=dmol,消耗的n(H2O)=dmol,则在反应I中生成的n(CO)=(b+d)mol,消耗的n(CH4)= (b+d)mol,消耗的n(H2O)= (b+d)mol,生成的n(H2)=(3b+3d)mol,则平衡时体系内:n(CH4)=(1-b-d)mol、n(H2O)=(4-b-2d)mol、n(CO)=bmol、n(H2)=(3b+4d)mol,容器体积为2L,故平衡常数 ,
,
故答案为:![]() ;
;
(3)A.适当增大反应物投料比武n(H2O):n(CH4),增大水的量促进甲烷转化成CO,促进CO转化成CO2,故A正确;
B.提高压强,反应I平衡左移,故B错误;
C.分离出CO2可使平衡右移,故C正确;
故答案为:AC;
(4)温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小;
设初始加入的N2为1 mol、H2为3 mol ,温度、体积一定时气体物质的量之比等于压强之比,气体物质的量减少4×10 % =0.4 mol;

其中p0=2×l07Pa ;
H2的转化率为0.6/3=20%;
平衡常数
故答案为:温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小;20%;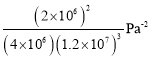 。
。

 阅读快车系列答案
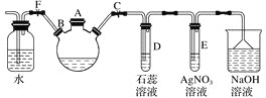
阅读快车系列答案【题目】下列实验操作和现象与结论对应关系正确的是![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 测量等浓度的 |
|
|
B | 将 | 溴水褪色 |
|
C | 取少量的变质 | 酸性高锰酸钾溶液褪色 |
|
D | 向苯酚的苯溶液中加入足量NaOH溶液,振荡静置 | 分层 | 上层为苯,下层为NaOH与苯酚钠的混合溶液 |
A.AB.BC.CD.