【题目】兴趣小组设计实验,测定![]() 与
与![]() 混合物中
混合物中![]() 的质量分数.
的质量分数.
甲方案:
实验步骤为:
![]() 称量空坩埚的质量为
称量空坩埚的质量为![]() ;
;![]() 称量装有试样的坩埚质量为
称量装有试样的坩埚质量为![]() ;
;
![]() 加热;
加热;
![]() 冷却;
冷却;
![]() 称量坩埚和残余物的质量为
称量坩埚和残余物的质量为![]() ;
;
![]() 重复
重复![]() 至
至![]() 操作,直至恒重,质量为
操作,直至恒重,质量为![]() 。
。
(1)坩埚中发生反应的化学方程式___________________________。
(2)计算![]() 质量分数为 _____________________________
质量分数为 _____________________________![]() 表达式
表达式![]() 。
。
乙方案:
准确称取![]() 样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用
样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用![]() 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为
的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为![]() ,即
,即![]() 。重复上述操作两次。
。重复上述操作两次。
![]() 配制上述盐酸标准溶液100ml,若用
配制上述盐酸标准溶液100ml,若用![]() 进行配制,需用量筒量取该HCl溶液________ml;定容时俯视刻度线,将导致配制的溶液浓度________。
进行配制,需用量筒量取该HCl溶液________ml;定容时俯视刻度线,将导致配制的溶液浓度________。![]() 填“偏高”、“偏低”或“没有影响”
填“偏高”、“偏低”或“没有影响”![]()
(4)根据下表数据,样品中![]() _________。
_________。![]() 保留三位有效数字
保留三位有效数字![]()
滴定次数 | 样品的质量 | 稀盐酸的体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
丙方案:称取![]() 样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
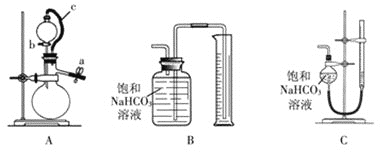
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?________![]() 填“漏气”、“不漏气”或“无法确定”
填“漏气”、“不漏气”或“无法确定”![]() 。实验时,装置A中c的作用_____________________,________________。
。实验时,装置A中c的作用_____________________,________________。
(6)为了提高测定的准确性,应选用装置A和_____![]() 填写字母标号
填写字母标号![]() 进行实验。
进行实验。
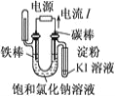
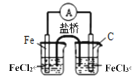
【题目】(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___。用离子方程式表示其原因___。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___。
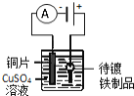
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___;正极反应式为___。
②反应过程中SO![]() 向____极移动。
向____极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___克。
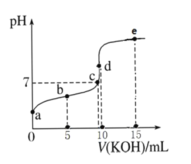
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1molL-1的四种溶液:pH由小到大排列的顺序是__(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1molL-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)
A.c(H+) B.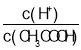 C.c(H+)c(OH-) D.
C.c(H+)c(OH-) D.![]() E.
E.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____(填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1molL-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____。