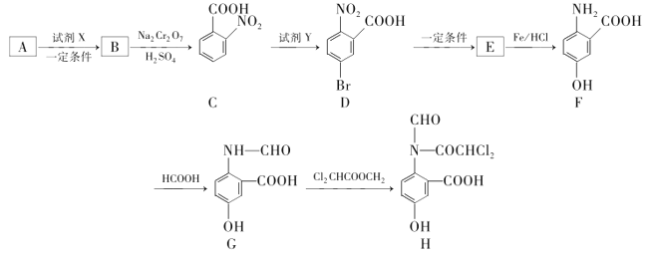
题目内容
【题目】常温下,Ksp(ZnS)=l.6×10-24,Ksp(FeS)=6.4×10-18,其中FeS为黑色晶体,ZnS是一种白色颜料的组成成分。下列说法正确的是
A.向物质的量浓度相等的FeSO4和ZnSO4混合液中滴加Na2S溶液,先产生黑色沉淀
B.常温下,反应FeS(s)+Zn2+(aq)ZnS(s)+Fe2+(aq)的平衡常数K=4.0×l06
C.在ZnS的饱和溶液中,加入FeSO4溶液,一定不会产生FeS沉淀
D.向FeS悬浊液中通入少许HC1,c(Fe2+)与Ksp(FeS)均增大
【答案】B
【解析】
A.Ksp(ZnS)<Ksp(FeS),根据Ksp小的先沉淀可知,先产生ZnS白色沉淀,故A错误;
B.反应FeS(s)+Zn2+(aq)ZnS(s)+Fe2+(aq)的平衡常数K=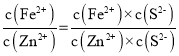
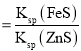 =
=![]() =4.0×l06,故B正确;
=4.0×l06,故B正确;
C.在ZnS的饱和溶液中,加入FeSO4溶液,由于FeSO4浓度未知,则Qc(FeS)可能大于Ksp(FeS),故可能产生FeS沉淀,故C错误;
D.Ksp(FeS)只与温度有关,通入少许HCl,Ksp(FeS)不变,故D错误;
答案选B。

练习册系列答案
相关题目