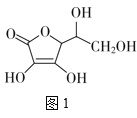
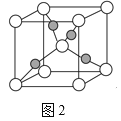
【题目】如表陈述Ⅰ、Ⅱ均正确,且两者在反应原理上相似的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 将 |
|
B |
|
|
C | 玻璃试剂瓶可用于盛放氢氟酸 | 石英坩埚不能用于熔化NaOH |
D |
|
|
A.AB.BC.CD.D
【题目】I.CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如表:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___,判断该反应是____反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___,判断该反应是____反应(填“吸热”或“放热”)。
II.T1温度下,体积为2L的恒容密闭容器,加入4.00molX,4.00molY,发生化学反应X(g)+Y(g)![]() 2M(g)+N(s) △H<0。
2M(g)+N(s) △H<0。
部分实验数据如下:
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)前500秒,反应速率v(M)=__ ,该反常数应的平衡K=___。
(3)该反应达到平衡时某物理量随温度变化如图所示。纵坐标可以表示的物理量有哪些__。

a.Y的逆反应速率 b.M的体积分数
c.混合气体的密度 d.X的转化率
(4)反应达到平衡后,若再加入2.00molM,1.00molN,下列说法正确的是____。
A.重新达平衡后,用X表示的v(正)比原平衡大
B.重新达平衡后,M的气体体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.25倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
(5)若容器为绝热恒容容器,起始时加入4.00molX,4.00molY,则达平衡后M的物质的量浓度____2mol/L(填“大于”、“小于”或“等于”)。