题目内容
【题目】I.CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如表:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___,判断该反应是____反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___,判断该反应是____反应(填“吸热”或“放热”)。
II.T1温度下,体积为2L的恒容密闭容器,加入4.00molX,4.00molY,发生化学反应X(g)+Y(g)![]() 2M(g)+N(s) △H<0。
2M(g)+N(s) △H<0。
部分实验数据如下:
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)前500秒,反应速率v(M)=__ ,该反常数应的平衡K=___。
(3)该反应达到平衡时某物理量随温度变化如图所示。纵坐标可以表示的物理量有哪些__。

a.Y的逆反应速率 b.M的体积分数
c.混合气体的密度 d.X的转化率
(4)反应达到平衡后,若再加入2.00molM,1.00molN,下列说法正确的是____。
A.重新达平衡后,用X表示的v(正)比原平衡大
B.重新达平衡后,M的气体体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.25倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
(5)若容器为绝热恒容容器,起始时加入4.00molX,4.00molY,则达平衡后M的物质的量浓度____2mol/L(填“大于”、“小于”或“等于”)。
【答案】![]() 吸热 2.4×10-3mol/(L·s) 4 bd AC 小于
吸热 2.4×10-3mol/(L·s) 4 bd AC 小于
【解析】
(1)依据化学平衡常数的表达式分析;
(2)前500秒,反应的n(X)=4.00-2.80=1.20mol,反应的物质的量之比等于化学计量数之比,根据化学反应速率的定义式计算;根据表中数据,反应在1000s时,达到平衡状态,
X(g)+Y(g)![]() 2M(g)+N(s)
2M(g)+N(s)
初始:4.00 4.00
反应:2.00 2.00 4.00
平衡:2.00 2.00 4.00
(3)依据温度对化学反应速率与化学平衡的综合影响效果分析作答;
(4)反应的方程式可逆号两边的气体计量数之比相等,反应达到平衡后,再加入2.00molM,1.00molN,平衡不移动,结合等效平衡的思想分析作答。
(1)K1=![]() ,K2=
,K2=![]() ,则K=
,则K= ![]() =
= ![]() ;973K时,K=
;973K时,K=![]() =0.62,1173K时,K=
=0.62,1173K时,K=![]() =1.29,则升高温度,K值增大,即平衡正向移动,则正反应为吸热反应;
=1.29,则升高温度,K值增大,即平衡正向移动,则正反应为吸热反应;
(2)前500秒,反应的n(X)=4.00-2.80=1.20mol,反应的物质的量之比等于化学计量数之比,则n(M)=2.40mol,v(M)=![]() = =
= =![]() =2.4×10-3mol/(L·s);根据表中数据,反应在1000s时,达到平衡状态,
=2.4×10-3mol/(L·s);根据表中数据,反应在1000s时,达到平衡状态,
X(g)+Y(g)![]() 2M(g)+N(s)
2M(g)+N(s)
初始:4.00 4.00
反应:2.00 2.00 4.00
平衡:2.00 2.00 4.00
则各物质的浓度分别为1.00mol/L,1.00mol/L,2.00mol/L,K=![]() =4;
=4;
(3)a.升高温度,Y的逆反应速率增大,与图像不符,a错误;
b.正反应为放热反应,升高温度,平衡逆向移动,M的物质的量减小,则体积分数减小,与图像符合,b正确;
c.正反应为放热反应,升高温度,平衡逆向移动,混合气体的质量增大,体积不变,则密度增大,与图像不符,c错误;
d.正反应为放热反应,升高温度,平衡逆向移动,X的转化率降低,与图像符合,d正确;
答案为bd;
(4)反应的方程式可逆号两边的气体计量数之比相等,反应达到平衡后,再加入2.00molM,1.00molN,平衡不移动,
A.重新达平衡后,X的浓度增大,则用X表示的v(正)比原平衡大,符合题意,A正确;
B.重新达平衡后,平衡不移动,M的气体体积分数不变,与题意不符,B错误;
C.再加入2.00molM,相当于3.00mol的X、Y,重新达平衡后,平衡常数不变,M的物质的量浓度是2.5mol/L,是原平衡的1.25倍,符合题意,C正确;
D.重新达平衡后,Y的浓度增大,则Y的平均反应速率与原平衡相等,与题意不符,D错误;
答案为AC。

 阅读快车系列答案
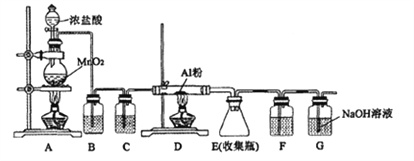
阅读快车系列答案【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定)。下列说法正确的是( )
实验序号 | 甲针筒内物质 | 乙针筒内物质 |
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
![]()
A.上述4个实验均发生了氧化还原反应
B.实验2,甲针筒内最终的无色气体是NO
C.实验3,甲针筒内充满黄绿色气体
D.实验4,甲针筒内活塞将向右移动
【题目】下表中对应关系错误的是( )
A | NaCl=Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO HCO | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH=NaCl+NaClO+H2O; 3S+6NaOH=2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
A.AB.BC.CD.D
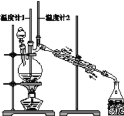
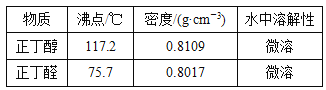
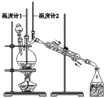
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
【题目】某![]() 待测溶液中除含有
待测溶液中除含有![]() 的
的![]() 外,还可能含有下列离子中的一种或多种:
外,还可能含有下列离子中的一种或多种:
阳离子 |
|
阴离子 |
|
现讲行如下实验操作![]() 每次实验所加试剂均过量
每次实验所加试剂均过量![]()
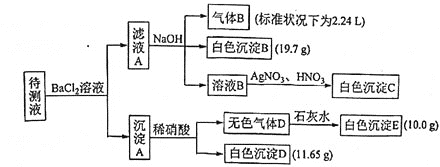
下列说法不正确的是
A.向溶液B中加![]() 与
与![]() 的操作是多余的,待测液中一定含有的离子是
的操作是多余的,待测液中一定含有的离子是![]() 、
、![]() 、
、![]() 、
、![]() ,且
,且![]()
B.生成白色沉淀B的离子方程式为
C.已知白色沉淀C能溶于浓氨水,离子方程式为![]()
D.若无色气体D是混合气体,则沉淀A的成分可能是![]() 、
、![]() 、
、![]()