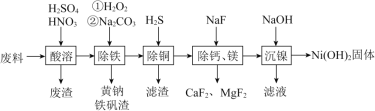
【题目】氯化亚铜![]() ,白色、易被氧化,
,白色、易被氧化,![]() 广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉
广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉![]() 主要含
主要含![]() 、CuS、
、CuS、![]() 、FeO等
、FeO等![]() 制备活性CuCl的流程如下:
制备活性CuCl的流程如下:
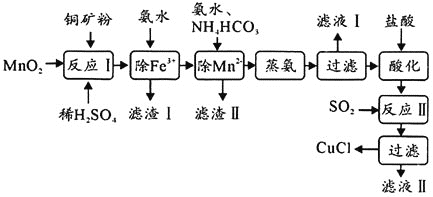
(1)滤渣Ⅰ是![]() 和单质硫的混合物,反应Ⅰ中
和单质硫的混合物,反应Ⅰ中![]() 参与反应的化学方程式为:
参与反应的化学方程式为:![]() 未配平
未配平![]() ,氧化产物为________。
,氧化产物为________。
(2)除![]() 时得
时得![]() 沉淀,该反应的离子方程式为________。
沉淀,该反应的离子方程式为________。
(3)已知![]() 可溶于氨水形成深蓝色溶液:
可溶于氨水形成深蓝色溶液:![]() 。蒸氨条件及蒸氨效果见下表:
。蒸氨条件及蒸氨效果见下表:
序号 | 温度 | 时间 | 压强 | 残液颜色 |
a | 110 | 60 |
| 浅蓝色 |
b | 100 | 40 |
| 几乎很浅 |
c | 90 | 30 |
| 无色透明 |
由表中信息可知蒸氨的条件应选________![]() 填序号
填序号![]() 。
。
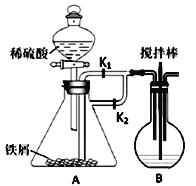
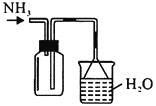
蒸出的氨气可以回收利用,在实验室用如图装置来收集。当集气瓶收集满氨气时观察到的现象是________。
(4)反应Ⅱ的离子方程式为________。
【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(Cl—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(3)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
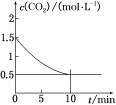
①该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________ mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉