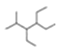
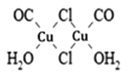
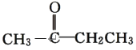【题目】对工业废气进行脱硝有多种方法。
(1)用活性炭还原法处理氮氧化物的反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
容器 | 温度 | 体积 | C(s) | NO(g) | N2(g) | CO2(g) |
甲 | 600℃ | V L | 1mol | 2mol | 0 | 0 |
乙 | 600℃ | V L | 0 | 0 | 2mol | 2mol |
①下列能说明甲容器中反应达到平衡状态的是_______。
a.容器的压强保持不变 b.v(NO)正=2v(CO2)逆
c.混合气体的密度保持不变 d.NO、N2、CO2的物质的量之比为2∶1∶1
②关于平衡时的甲、乙两容器,下列说法一定正确的是_______。
a.p(甲)=p(乙) b.c(NO)甲=c(CO2)乙
c.2c(CO2)甲=c(N2)乙 d.体积分数φ(CO2)甲=φ(N2)乙
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用生成亚硝酰氯(ClNO),涉及反应如下:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)
2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)![]() 2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
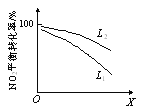
(3)利用O3进行如下脱硝反应:2NO2(g)+O3(g)![]() N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
(4)用稀硝酸吸收NOx进行脱硝,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_______。
【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
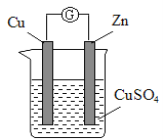
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥