题目内容
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
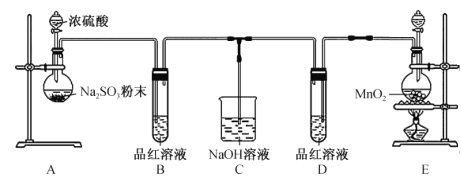
(2)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为___________。
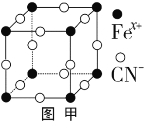
(3)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)_____________
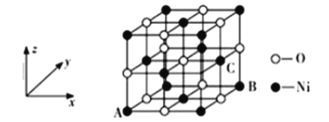
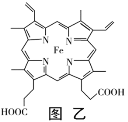
(4)某种磁性氮化铁的结构如图2所示,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
【答案】CO2 (或CS2、BeCl2) 1:1 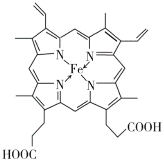 六方最密 Fe3N 12
六方最密 Fe3N 12 ![]()
【解析】
根据同族替换和等量代换原则找等电子体。根据均摊法和电荷守恒确定晶体的化学式。根据N原子的电子层结构和成键特点分析其在配合物中的成键情况。根据原子的空间排列特点分析其堆积方式,根据均摊法确定晶体的化学式,进一步根据晶胞的质量和体积求其密度。
(1) SCN由3个原子组成,其价电子总数为16,根据同族替换和等量代换原则,可以找到多种等电子体,其中与SCN互为等电子体且为非极性分子有CO2 、CS2或BeCl2等。
(2)由普鲁士蓝的晶胞结构示意图及量中说明可知,Fe原子位于晶胞的顶点,CN-位于棱边,平均每两个晶胞立方体中含有一个K+,平均每个晶胞中占有1个Fe原子、3个CN-,K+、Fe原子、CN-的个数比为1:2:6,又知该晶体中铁元素有+2价和+3价两种,根据电荷守恒可知,1+3N(Fe3+)+2N(Fe2+)=6,N为正整数,则N(Fe3+)=N(Fe2+)=1,Fe3+与Fe2+的个数比为1:1。
(3)由血红素铁结构示意图可知,由于N原子最外层有5个电子,每个N原子必须形成3个σ键,因此,其中只有2个形成双键的N原子可以作为配位原子形成配位键,另外2个N原子与Fe形成σ键,所以, Fe2+与N原子间的化学键可以表示为 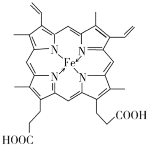 。
。
(4)根据磁性氮化铁的结构示意图可知,Fe位于正六棱柱的12个顶点和2个面心及体内,其配位数为12,呈ABABAB形密置排列,故其为六方最密堆积。在该晶胞中平均占有的Fe原子数为(12![]() +2
+2![]() +3)=6;N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
+3)=6;N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,由图可知,晶胞中有2个N原子,则Fe与N的原子个数比为3:1,所以该化合物的化学式为Fe3N。因为Fe原子的排列方式为六方最密堆积,所以距离铁原子最近的铁原子的个数为12;氮化铁晶胞底边长为a nm,高为c nm,晶胞底面为正六边形,其面积为6
,由图可知,晶胞中有2个N原子,则Fe与N的原子个数比为3:1,所以该化合物的化学式为Fe3N。因为Fe原子的排列方式为六方最密堆积,所以距离铁原子最近的铁原子的个数为12;氮化铁晶胞底边长为a nm,高为c nm,晶胞底面为正六边形,其面积为6![]()
![]() =
=![]() ,则晶胞的体积为
,则晶胞的体积为![]() ,晶胞的质量为
,晶胞的质量为![]() ,则这种磁性氮化铁的晶体密度为
,则这种磁性氮化铁的晶体密度为
![]() g·cm-3。
g·cm-3。

【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同, | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸过程中,在 | 增大气液接触面积,使 |
C | 在2L密闭容器中发生反应:
| 反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A.AB.BC.CD.D
【题目】某化学兴趣小组欲测定KClO3,溶液与![]() 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和
溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
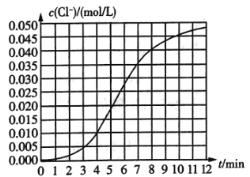
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() ________
________![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。
方案 | 假设 | 实验操作 |
Ⅰ | 该反应放热使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mo//L的 |
Ⅱ | 取10mL0.1mo/L的 | |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向a、b两只烧杯中加入10mL0.1mol/L的 |
①补全方案Ⅰ中的实验操作:________。
②方案Ⅱ中的假设为________。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。
④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。
⑤反应后期,化学反应速率变慢的原因是________。
【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
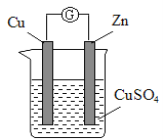
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥