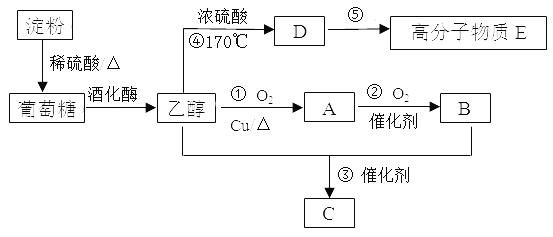
题目内容
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
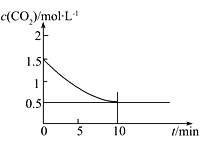
①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时![]() 增大的是__________(填序号) 。
增大的是__________(填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a. 容器中的压强不变 b.气体的密度不再改变
c. v正(CO2)=v逆(CO) d. c(CO2)=c(CO)
e. 容器内气体总物质的量不变
【答案】(1)ΔH1-ΔH2 K1/K2 吸热 (2)①2.0 0.67(或2/3) ②A ③bc
【解析】
试题分析:(1)已知反应① Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应② Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2
FeO(s)+H2(g) ΔH2,平衡常数为K2
根据盖斯定律可知①-②即得到反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的ΔH=ΔH1-ΔH2,平衡常数K=K1/K2;根据表中数据可知随温度的升高,K1增大,K2减小,所以K值随温度升高而增大,因此反应CO2(g)+H2(g)
CO(g)+H2O(g)的ΔH=ΔH1-ΔH2,平衡常数K=K1/K2;根据表中数据可知随温度的升高,K1增大,K2减小,所以K值随温度升高而增大,因此反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是吸热反应。
CO(g)+H2O(g)是吸热反应。
(2)①根据表中数据可知平衡时二氧化碳浓度是0.5mol/L,消耗二氧化碳浓度是1.0mol/L,因此生成CO浓度是1.0mol/L,则该条件下反应的平衡常数为![]() ;若铁粉足量,CO2的
;若铁粉足量,CO2的
起始浓度为2.0 mol·L-1,设平衡时CO2的浓度为xmol/L,则![]() ,解得x=
,解得x=![]() 。
。
②A.正反应吸热,升高温度平衡向正反应方向进行,则![]() 增大,A正确;B.反应前后体积不变,增大压强
增大,A正确;B.反应前后体积不变,增大压强![]() 不变,B错误;C.再充入一定量的CO2平衡常数不变,则
不变,B错误;C.再充入一定量的CO2平衡常数不变,则![]() 不变,C错误;D.再加入一定量铁粉,平衡不移动,
不变,C错误;D.再加入一定量铁粉,平衡不移动,![]() 不变,D错误,答案选A。
不变,D错误,答案选A。
③a. 反应前后体积不变,,则容器中的压强始终不变,a错误;b.反应前后气体的质量变化,容积不变,则气体的密度不再改变说明反应达到平衡状态,b正确;c. v正(CO2)=v逆(CO)表示反应速率方向相反,且满足反应速率之比是相应的化学计量数之比,说明反应达到平衡状态,c正确;d. c(CO2)=c(CO)没有指明反应的方向,则反应不一定达到平衡状态,d错误;e. 反应前后体积,则容器内气体总物质的量始终不变,不能说明反应达到平衡状态,e错误,答案选bc。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案