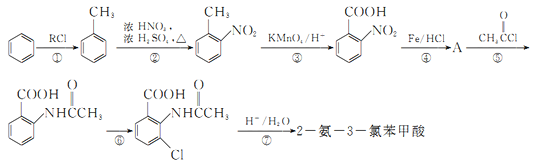
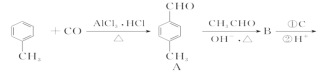
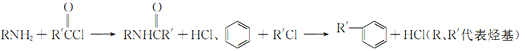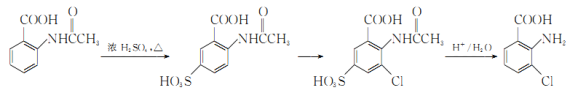题目内容
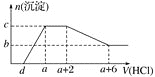
【题目】某溶液中可能含有![]() ,某同学为了确定其组分,设计并完成了如图实验:
,某同学为了确定其组分,设计并完成了如图实验:
由此可推测原溶液中
A.一定存在![]() ,一定不存在
,一定不存在![]()
B.一定存在![]() ,一定不存在
,一定不存在![]()
C.![]() 至少为
至少为![]()
D.![]() 一定为
一定为![]()
【答案】C
【解析】
加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,为Fe2+或Fe3+或二者都有,则原溶液中一定没有CO32-;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子,由溶液为电中性可判断是否存在氯离子,以此来解答。
加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02mol NH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,为Fe2+或Fe3+或二者都有,则原溶液中一定没有CO32-;由于加入了NaOH,无法判断原溶液中是否含有Na+;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,则原溶液中含有0.02mol硫酸根离子,由电荷守恒可知原溶液中一定有Cl,物质的量至少为0.02mol×2+0.02mol0.02mol×2=0.02mol;
A. 原溶液中一定存在SO42-、NH4+、Cl-,一定不存在CO32-;由于第一步中加入了氢氧化钠溶液,引入了钠离子,无法确定原溶液中是否含有钠离子,故A错误;
B.由A项分析可知,无法确定原溶液中是否含有钠离子,故B错误;
C. 由以上分析可知,原溶液中一定存在0.02mol NH4+、0.02mol SO42-、0.02molFe2+或Fe3+或二者都有,若为Fe2+,正电荷物质的量为0.02mol×2+0.02mol=0.06mol,而负电荷的物质的量为0.02mol×2=0.04mol,根据溶液电中性可知,原溶液中一定存在Cl,且c(Cl)(0.06mol0.04mol)/0.1L=0.2molL1,故C正确;
D. 由上述分析可知,原溶液中可能含有Fe2+或Fe3+或二者都有,则无法判断Fe3+的物质的量浓度,故D错误;
故答案为C。

 轻巧夺冠周测月考直通中考系列答案
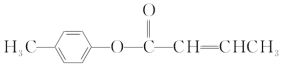
轻巧夺冠周测月考直通中考系列答案【题目】甲醇、二甲醚(CH3OCH3) 既是重要的化工原料,又是可再生能源,具有开发和应用广阔前景。
(1)合成二甲醚的反应原理为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①该反应能够自发进行的原因是_______。
②若容器的体积恒定不变,CO、H2起始通入量分别为2 mol、4 mol,充分反应后达到平衡。下列措施既可以提高反应速率又可以提高CO的转化率是_______。
a.升高温度 b.使用更高效的催化剂
c.充入He,使体系总压强增大 d.缩小体积增大压强
(2)工业上合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1
CH3OH(g) ΔH=-91 kJ·mol-1
①已知某些化学键的键能数据如下表,则x=_______。
化学键 | C-H | H-H | C-O | C≡O | O-H |
键能/ kJ·mol-1 | a | b | c | x | d |
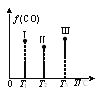
②在Ⅰ、Ⅱ、Ⅲ三个恒压容器中分别充入a mol CO和2a mol H2合成甲醇,三个容器的温度分别为T1、T2、T3。若实验测得反应均进行到t min时,三个容器中CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是_____。若反应达到平衡,三个容器中v(CH3OH)逆最大的是____。
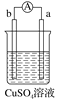
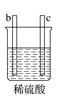
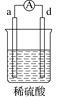
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c